Nhuộm H&E thường quy và nhuộm đặc biệt đóng một vai trò quan trọng trong chẩn đoán hoặc nghiên cứu dựa trên mô. Bằng cách nhuộm màu các phần mô trong suốt, mô sau khi nhuộm cho phép các nhà nghiên cứu soi dưới kính hiển vi để phân tích hình thái mô (cấu trúc) hoặc phát hiện các loại tế bào, vi sinh vật hoặc vi khuẩn.
Trong phòng thí nghiệm mô bệnh học, “nhuộm thường quy” là nhuộm hematoxylin và eosin (H&E) được sử dụng “thường xuyên” với tất cả các mẫu mô để phát hiện các cấu trúc và tình trạng mô cơ bản. Nhuộm đặc biệt để chỉ một số lượng lớn các kỹ thuật nhuộm thay thế được sử dụng khi H&E không cung cấp tất cả thông tin mà nhà nghiên cứu bệnh học hoặc nhà nghiên cứu cần.
Chuẩn bị mô để nhuộm
Trước khi nhuộm và quan sát mô, mô phải được cắt thành những lát mỏng, đặt mô trên lam kính. Cố định mô sau đó làm đông lạnh mô để có thể cắt thành những phần mỏng (thường là 2–7 µm). Có hai kỹ thuật chính được sử dụng cho việc này, được gọi là làm đông lạnh mô và vùi mô trong sáp paraffin.
Các phần mô đông lạnh được sử dụng khi cần kết quả nhanh chóng, thường là trong quá trình phẫu thuật để cắt bỏ khối u. Tuy nhiên, kỹ thuật này thường không tạo ra chất lượng phần cắt giống như kỹ thuật paraffin. Quá trình chuẩn bị cắt mô đông lạnh như sau:
- Mô được đông lạnh nhanh chóng để bảo quản mô
- Sử dụng máy cắt lạnh để cắt mô và đặt trên lam kính để tiến hành nhuộm màu
- Phần mô cần được cố định trước khi nó phân hủy và nhuộm màu sau đó.
Khi chuẩn bị các phần paraffin, mẫu thử trước tiên được bảo quản bằng chất cố định và sau đó cấu trúc mô được hỗ trợ bằng cách vùi mô vào sáp parafin. Quá trình này tốn nhiều thời gian hơn so với việc tạo các phần đông lạnh, nhưng mang lại chất lượng nhuộm tốt hơn trong hầu hết các trường hợp và các mẫu thu được (được gọi là khối) có thể được lưu trữ được lâu. Quá trình cắt parafin như sau:
- Cố định mô giúp bảo quản mô (thường sử dụng dung dịch gốc formaldehyde).
- Phẫu tích vị trí mô cắt cụ thể
- Xử lý mô sử dụng một chuỗi thuốc thử để thay thế môi trường nước (gốc nước) bằng môi trường kỵ nước cho phép các thành phần mô được vùi bằng sáp parafin.
- Vùi đúc mô cho phép định hướng mẫu và bảo vệ mẫu trong một khối sáp để cắt và bảo quản mẫu.
- Việc cắt lát được thực hiện trên một máy cắt vi phẫu để cắt những phần mô được làm ướt, sau đó đặt lên lam kính
- Sau đó, các tiêu bản được làm khô trong tủ sấy để loại bỏ độ ẩm và giúp mô bám vào tiêu bản.
- Mô trên tiêu bản lúc này đã sẵn sàng để nhuộm
- Bước nhuộm đầu tiên là vùi đúc sáp, sử dụng dung môi để loại bỏ sáp khỏi tiêu bản trước khi nhuộm. Điều này luôn được thực hiện như một phần của quá trình nhuộm màu. Khi nhuộm hoàn tất, phần mô này sẽ được phủ với một lam kính để duy trì quá trình chuẩn bị mô

Tại sao nhuộm H&E là thường quy
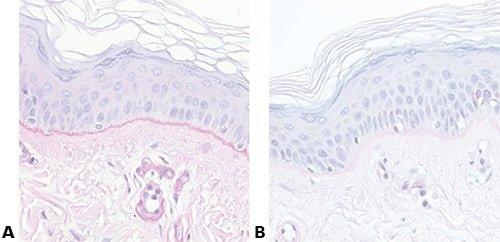
Nhuộm Hematoxylin và Eosin (H&E) được sử dụng thường quy trong các phòng thí nghiệm mô bệnh học vì nó cung cấp cho nhà nghiên cứu bệnh học cái nhìn rất chi tiết về mô. Nhuộm màu rõ ràng các cấu trúc tế bào bao gồm tế bào chất, nhân, bào quan và các thành phần ngoại bào. Điều này thường đủ để cho phép chẩn đoán bệnh dựa các tế bào và cũng cho thấy bất kỳ sự bất thường hoặc chỉ số cụ thể nào trong tế bào thực tế. Ngay cả khi sử dụng các phương pháp nhuộm tiên tiến, nhuộm H&E vẫn tạo thành một phần quan trọng trong hình ảnh chẩn đoán vì nó hiển thị hình thái mô cơ bản, cho phép nhà nghiên cứu bệnh học giải thích chính xác qua mô nhuôm
Trong phòng thí nghiệm mô học lâm sàng, tất cả các mẫu ban đầu được nhuộm bằng H&E và các nhuộm đặc biệt hoặc nâng cao chỉ được yêu cầu nếu cần thêm thông tin để cung cấp phân tích chi tiết hơn, ví dụ để phân biệt giữa hai loại ung thư giống nhau về hình thái.
Do khối lượng nhuộm H&E cần thiết, hầu hết các phòng xét nghiệm lâm sàng đều sử dụng hệ thống hoàn toàn tự động và hiện nay việc nhuộm thủ công rất hiếm.
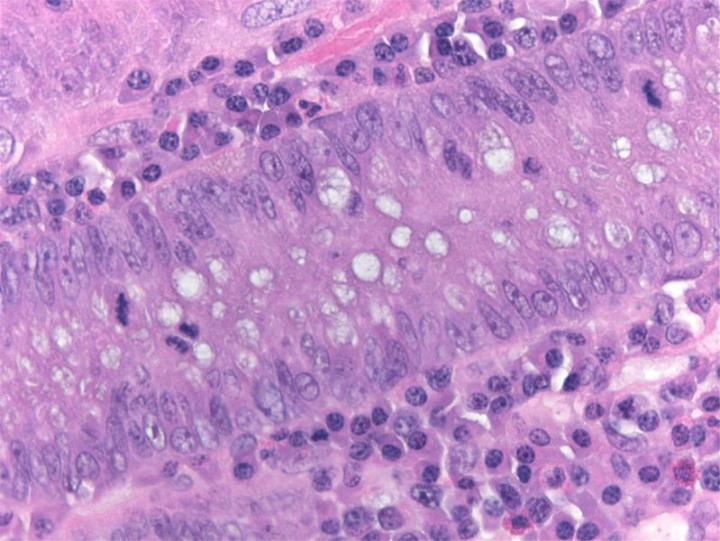
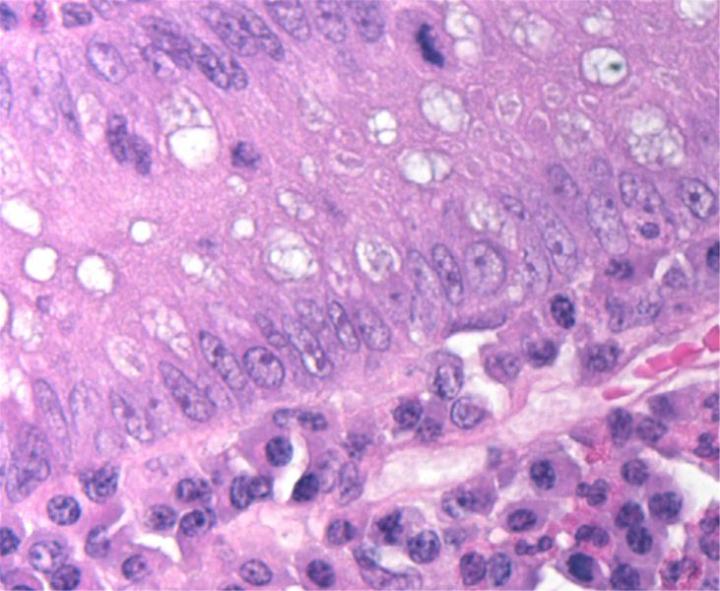
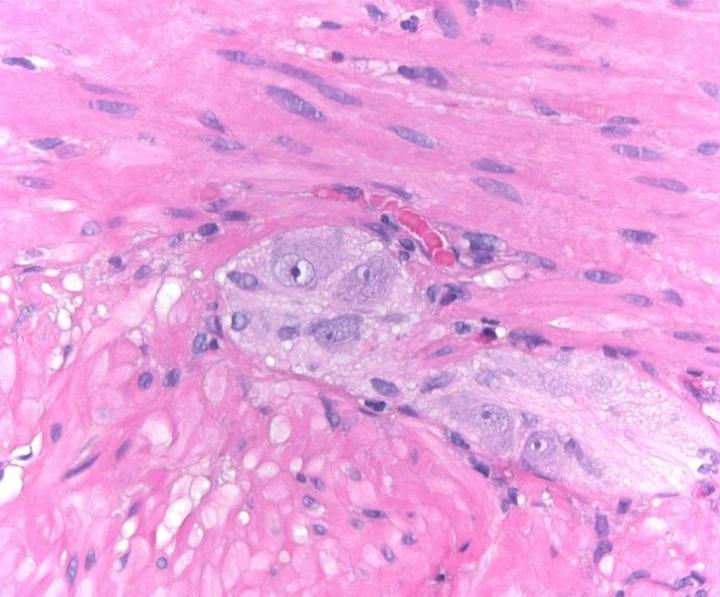
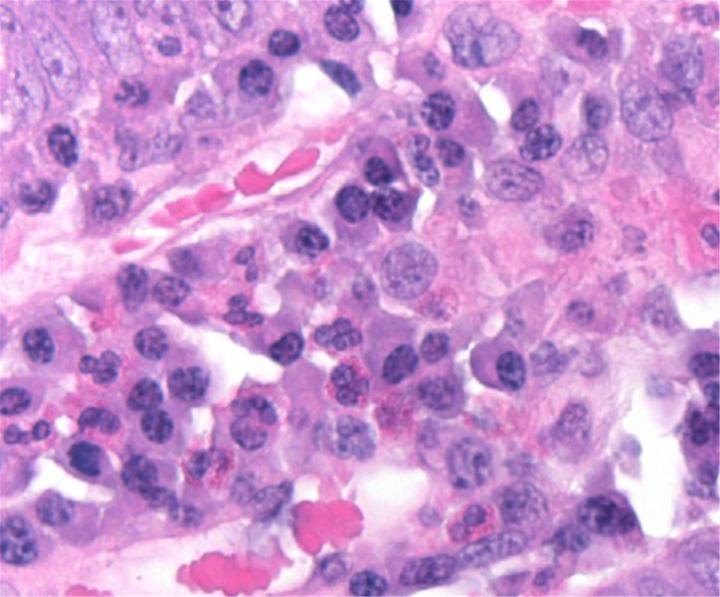
Thuốc nhuộm H&E
Thuốc nhuộm H&E sử dụng hai loại thuốc nhuộm: hematoxylin và eosin để nhuộm các thành phần mô khác nhau.
Hematoxylin phản ứng giống như thuốc nhuộm cơ bản có màu xanh tía. Nó nhuộm màu cấu trúc axit hoặc basophilic, bao gồm nhân tế bào (chứa DNA và nucleoprotein) và các bào quan có chứa RNA như ribosome và mạng lưới nội chất thô.
Eosin là thuốc nhuộm có tính axit thường có màu đỏ hoặc hồng. Nó nhuộm các cấu trúc cơ bản hoặc ưa axit, bao gồm tế bào chất, thành tế bào và các sợi ngoại bào.
Nguồn gốc thuốc nhuộm
Hematoxylin được chiết xuất từ cây gỗ tròn và được tinh chế. Sau đó nó được oxy hóa và kết hợp với chất gắn màu (thường là nhôm) để cho phép nó liên kết với các cấu trúc tế bào. Trong số nhiều chế phẩm hematoxylin được sử dụng trong mô học, hematoxylin của Gill, hematoxylin của Harris và hematoxylin của Mayer là phổ biến nhất.
Eosin được hình thành do phản ứng giữa brom và fluorescein. Có hai biến thể eosin thường được sử dụng trong mô học: eosin Y có màu hơi vàng và eosin B có màu hơi xanh. Eosin Y là phổ biến nhất.
Nhuộm đặc biệt
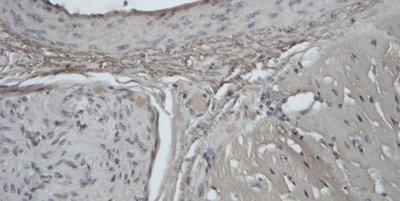
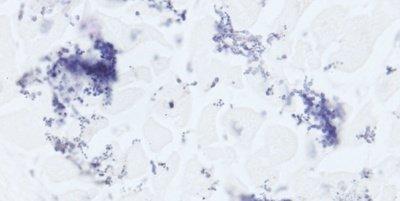
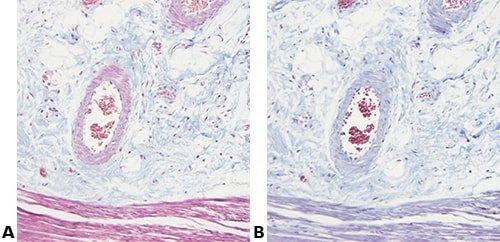
Nhuộm đặc biệt đề cập đến bất kỳ vết nhuộm nào khác ngoài H&E. Nó bao gồm nhiều phương pháp khác nhau có thể được sử dụng để hiển thị các cấu trúc, thành phần mô cụ thể hoặc thậm chí các vi sinh vật không được xác định bằng phương pháp nhuộm H&E.
Các phương pháp nhuộm màu khác sử dụng hóa mô miễn dịch hoặc lai tại chỗ để xác định các protein hoặc trình tự DNA/RNA cụ thể. Những phương pháp này đôi khi cũng được xem là nhuộm đặc biệt. Tuy nhiên, chúng khá khác nhau về phương pháp và mục đích và hiện nay thường được gọi là “nhuộm nâng cao”
Mặc dù có hàng trăm vết nhuộm đặc biệt cho mọi mục đích nhưng chỉ một số ít được sử dụng đều đặn trong mô học lâm sàng. Sự đa dạng của các vết nhuộm cũng có nghĩa là quá trình nhuộm đặc biệt không được tự động hóa như nhuộm H&E. Mặc dù nhiều phòng thí nghiệm lớn hơn sử dụng các thiết bị tự động để xử lý các mô nhuộm phổ biến hơn nhưng vẫn có thể nhuộm thủ công. Có một số vết nhuộm phức tạp, khó có thể áp dụng phương pháp nhuộm tự động hóa
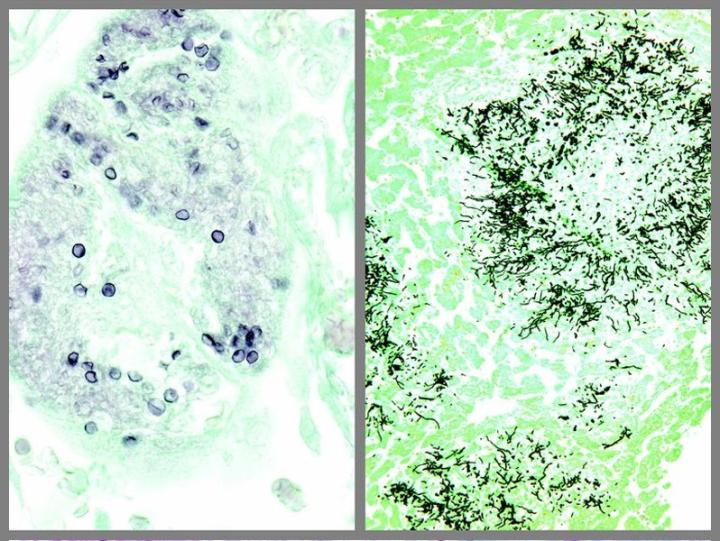
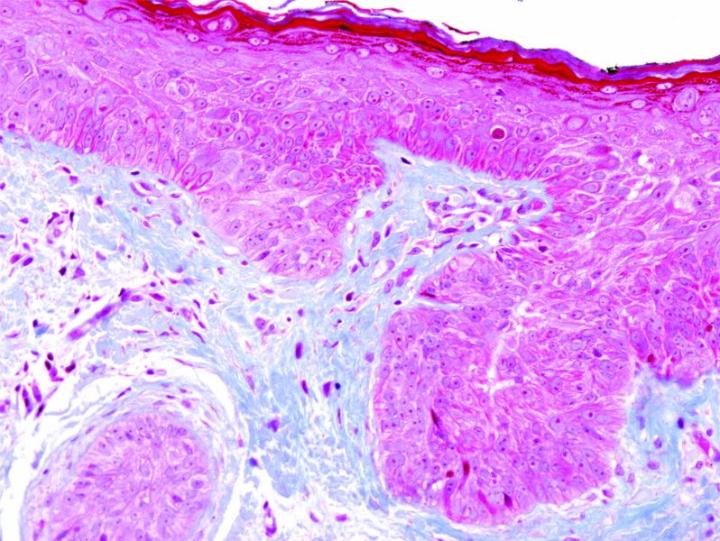
Một số vết nhuộm đặc biệt thường gặp
Những hình ảnh dưới đây minh họa một số vết nhuộm đặc biệt phổ biến và ứng dụng của nó
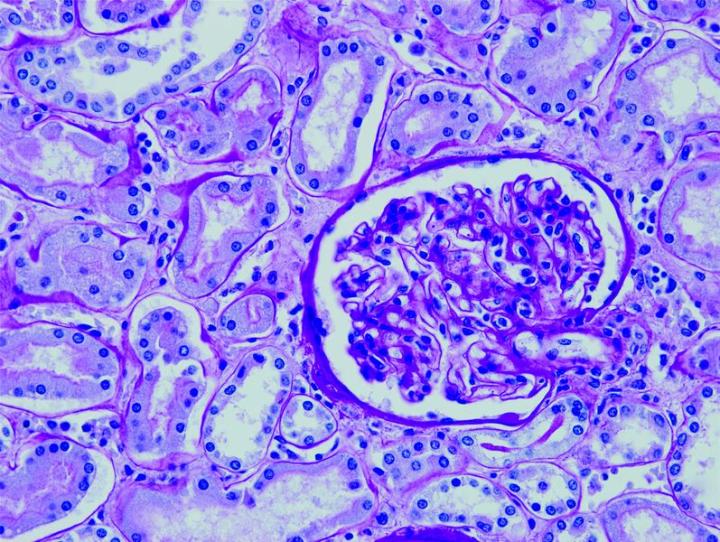
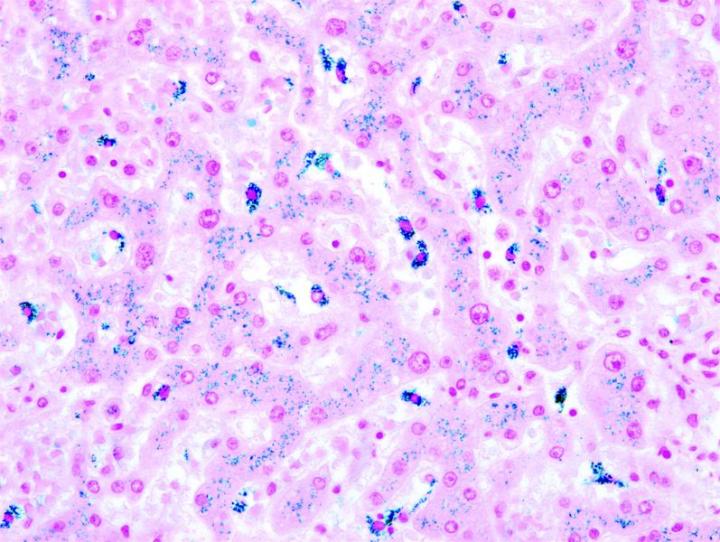
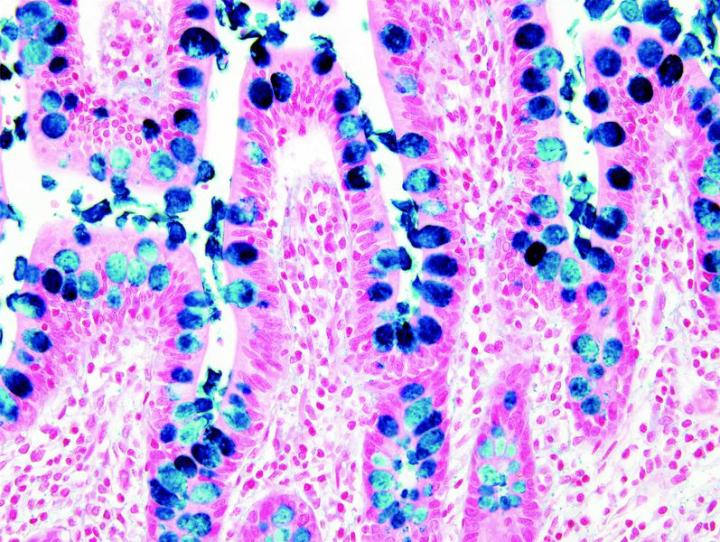
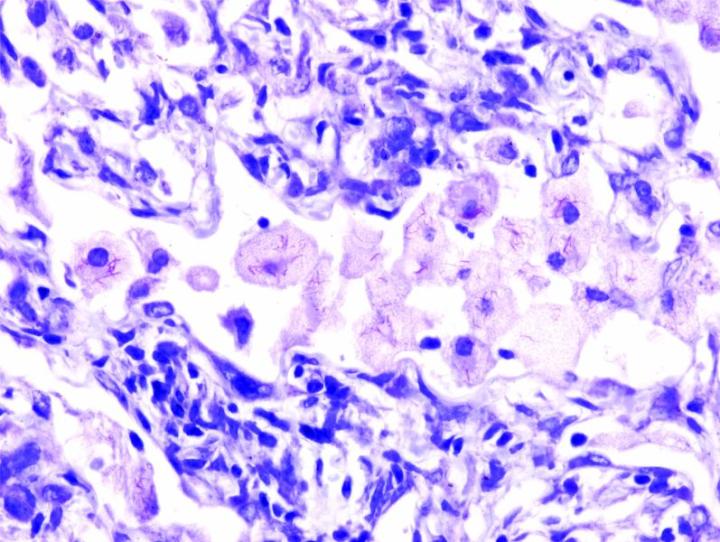
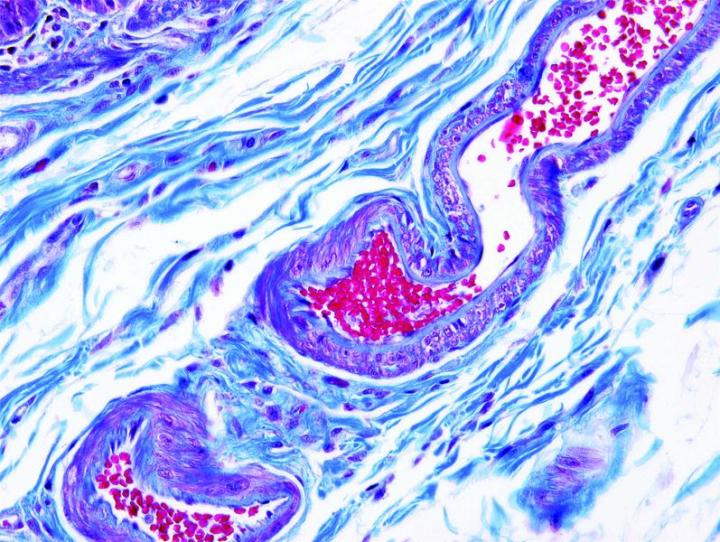
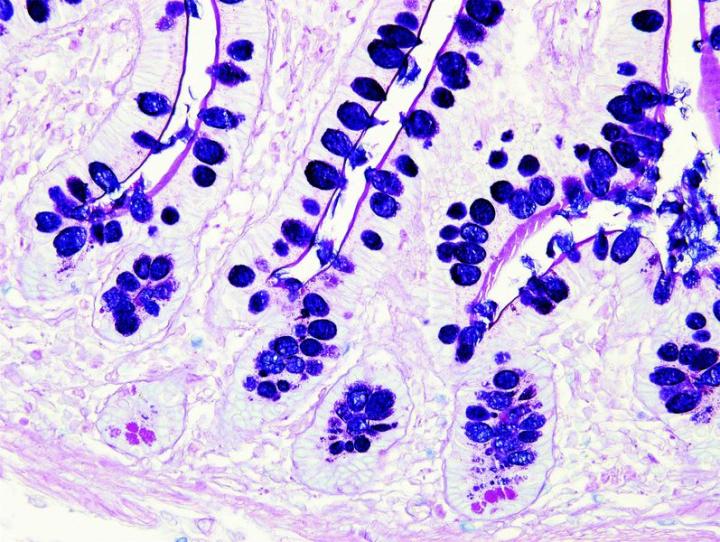
Các bước để xử lý các vết nhuộm đặc biệt
Xác định vết nhuộm
Xác định vết mô nhuộm để đánh giá tình trạng bệnh nào
Chỉ làm theo phương pháp, không để ý đến phần hoàn thiện sẽ dẫn đến kết quả không tốt.
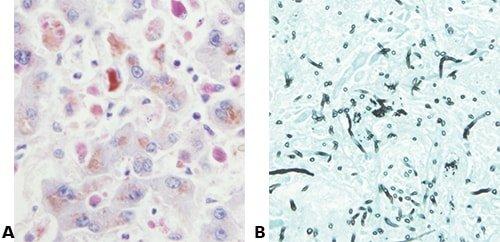
Sử dụng phương pháp đối chứng
Luôn sử dụng tiêu bản đối chứng có chứa cấu trúc/nội dung đang trình bày.
“Nếu cấu trúc/chất đang nhuộm không hiển thị trên tiêu bản, nghĩa là chúng không có”
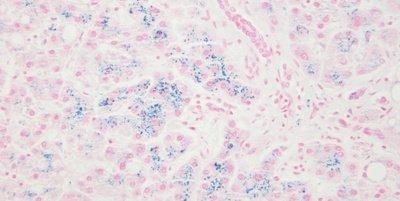
Nhuộm trong thời gian quy định
Thời gian chính xác.
Thời gian gần đúng. Thời gian không chính xác tạo ra kết quả không nhất quán.
Xem xét độ ổn định của thuốc thử
Lưu ý hạn sử dụng của thuốc thử. Một số thuốc thử hoặc dung dịch thuốc nhuộm có thể dùng được lâu trong khi một số khác không ổn định và phải được pha mới và sử dụng ngay. Những loại khác phải để một thời gian để oxy hóa trước khi có thể sử dụng được.
Có thể dùng thuốc thử quá hạn sử dụng
Bảo quản thuốc thử đúng cách
Bảo quản thuốc thử đúng cách. Một số yêu cầu bảo quản lạnh vì chúng có xu hướng tạo điều kiện nấm mốc phát triển. Những loại khác rất nhạy với ánh sáng và cần bảo quản trong bóng tối.
Tất cả thuốc thử đều được đặt lên bàn nhuộm, vi sinh vật có thể xâm nhập bất cứ lúc nào
Tuân thủ phương pháp
Thực hiện phương pháp chính xác
Kết quả khác nhau trong cùng một phương pháp
Ghi lại sự thay đổi trong quy trình
Ghi lại bất kỳ sự khác biệt nào so với phương pháp đang sử dụng
Kết quả kém, rất khó hoặc không thể tìm ra lý do vì những thay đổi trong quy trình chưa được ghi lại.
Chuẩn hóa các bước làm sạch
Chuẩn hóa các bước làm sạch
Sử dụng các phương pháp làm sạch khác nhau (tẩy rửa quá nhẹ hoặc mạnh)
Soi cẩn thận dưới kính hiển vi
Soi cẩn thận dưới kính hiển vi để đánh giá vết nhuộm
Đối với tất cả các phương pháp, mức độ nhuộm màu được đánh giá bằng cách nhìn vào lam kính bằng mắt thường.
Nguồn: https://www.leicabiosystems.com/knowledge-pathway/an-introduction-to-routine-and-special-staining/
Minh Khang là nhà phân phối và nhập khẩu trực tiếp các thiết bị Giải phẫu bệnh từ hãng Leica Biosystems.


 EN
EN