Nhuộm H&E là một phương pháp tương đối đơn giản để thực hiện, nhưng có nhiều yếu tố có thể gặp phải và tạo ra cát lát mô không đạt chất lượng.
Một số vấn đề thường gặp khi nhuộm H&E
Cắt lát mô đóng vai trò thiết yếu để có được mô nhuộm chất lượng. Hiện nay, nhiều phòng thí nghiệm đã thực hiện cắt mô trên máy cắt lát tiêu bản tự động, điều này không chỉ mang đến những lát mô đều, nhất quán mà còn an toàn cho người sử dụng.

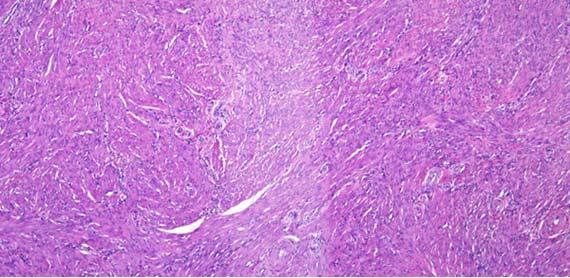
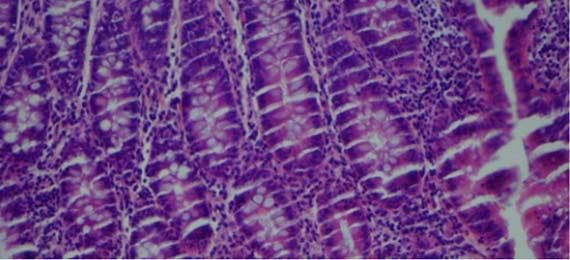
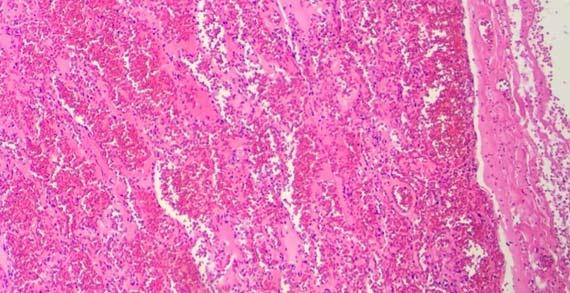
Nước thường được sử dụng làm chất phân biệt eosin vì nó có thể loại bỏ eosin thừa ra khỏi tiêu bản. Cồn khử nước và cồn 100% đầu tiên có thể chứa đủ nước để làm nhạt eosin và phân biệt rõ hơn eosin. Quá nhiều bước sẽ làm màu của eosin nhạt hơn và làm mờ cấu trúc tế bào chất.
Trong khi nhuộm, nước có thể thấm vào rượu (theo eosin) do sự chuyển màu giữa các bước. Khi thuốc thử không được thay thường xuyên, hàm lượng nước sẽ tiếp tục tăng và sẽ được chuyển sang các xylen tiếp theo trước khi phủ lên. Lượng nước thừa trong xylen này theo thời gian có thể gây ra hiện tượng eosin thấm ra khỏi mô. Nó được nhìn thấy trên tiêu bản như hình dưới đây. Hiện tượng này có thể xảy ra ngay cả khi xylene không bị nhiễm nước.
Tùy thuộc vào vị trí, chất lượng nước có thể khá khác nhau. Fluor hóa, độ pH hoặc các khoáng chất khác có thể ảnh hưởng không chỉ đến cách mô tiếp nhận thuốc nhuộm mà còn ảnh hưởng đến tuổi thọ của thuốc nhuộm. Ví dụ, vì hematoxylin có tính axit nhẹ nên nước có độ pH cơ bản có thể làm tăng độ pH của hematoxylin, khiến nó kém hiệu quả hơn. Nếu chất lượng nước kém hoặc thay đổi thì việc sử dụng nước khử ion (DI) là một lựa chọn tốt nhất. Chỉ cần nhớ đảm bảo áp lực nước DI đủ cho thuốc nhuộm.
Mô đông lạnh có thể là mẫu rất khó nhuộm. Thời gian rất quan trọng nên việc rút ngắn thời gian nhuộm màu cho phép nhà nghiên cứu bệnh học phản hồi nhanh chóng với nhân viên phẫu thuật.
Tuy nhiên, một trong những vấn đề lớn nhất là sự nhuộm màu không đồng đều, không liên quan đến việc cắt mô đông lạnh. Nguyên nhân đầu tiên có thể kể đến ở quy trình cố định mô và rửa tiêu bản trước khi nhuộm. Hãy nhớ rằng môi trường được sử dụng để hỗ trợ các mô đông lạnh trong quá trình cắt có thể hòa tan trong nước và PHẢI được loại bỏ khỏi mẫu, không khác gì loại bỏ parafin khỏi các mẫu thông thường trước khi nhuộm. Chất này thậm chí có thể ngăn chặn sự xâm nhập của thuốc nhuộm giống như sáp parafin. Và, không giống như sáp, bạn có thể sẽ không thấy bất kỳ vết nào còn sót lại nào trên tiêu bản khi kết thúc quá trình nhuộm, bởi vì nó đã bị loại bỏ trong quá trình nhuộm.
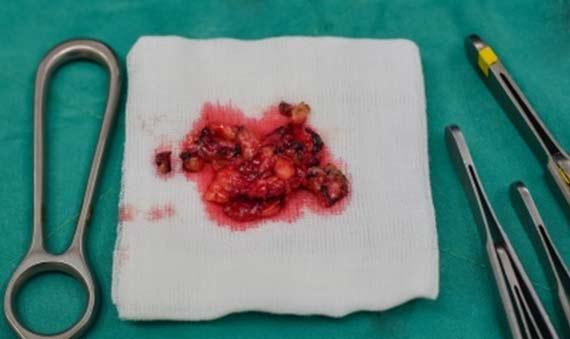
Các mẫu thường không được nhân viên phòng thí nghiệm thu thập, vì vậy việc đào tạo nhân viên lấy mẫu là điều cần thiết. Thu thập mẫu bằng cách sử dụng miếng gạc, dụng cụ có đầu bông hoặc các thiết bị trung gian khác có thể làm khô mẫu. Hiện tượng này thường thấy nhất khi sinh thiết, đặc biệt khi nhiều mẫu được thu thập từ cùng một bệnh nhân bằng cùng một thiết bị thu thập. Đối với những trường hợp này, việc rửa thiết bị thu thập bằng formalin có thể gây hại cho bệnh nhân, nên sử dụng vật liệu không xốp để lấy mô ra khỏi thiết bị. Nước muối cũng có thể được sử dụng để rửa mô từ thiết bị sang vật chứa khác vì nó sẽ không làm mất nước khỏi mẫu đã thu thập.
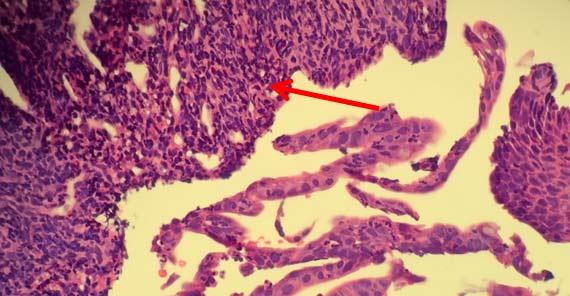
Mẫu phải được thu thập và ngay lập tức được ngấm vào chất cố định để đảm bảo sự cố định thích hợp. Formalin là chất cố định được sử dụng phổ biến nhất trong phòng thí nghiệm. Tuy nhiên, formalin phải được xử lý như bất kỳ thuốc thử nào khác, đặc biệt là về ngày bảo quản và hết hạn. Để formalin dưới ánh nắng trực tiếp có thể làm thay đổi độ pH của dung dịch, gây ra môi trường axit cho các mô. Tính axit trong chất cố định có xu hướng có hai tác động chính lên mô:
- Làm khô các cạnh bên ngoài của các mô
- Làm khô mô quá mức
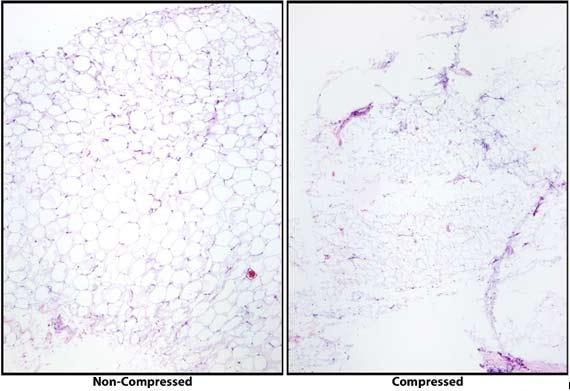
Khi bộ xử lý mô phát triển, kỹ thuật xử lý của chúng ta cũng phát triển. Từ đó, thời gian của quy trình xử lý ngày càng được sắp xếp hợp lý hơn để đáp ứng nhu cầu của bệnh nhân bằng cách tạo ra hiệu quả trong quá trình xử lý. Vì lý do này, việc đặt tất cả các mẫu lại với nhau trên cùng một giao thức là không còn hợp lý nữa. Các mẫu nhỏ được đặt qua quy trình qua đêm sẽ bị mất nước quá mức, khiến việc phân chia trở nên khó khăn. Ngâm có thể giúp ích, nhưng thường sẽ khiến mô bị nứt. Các mẫu lớn được đặt theo quy trình thích hợp hơn cho sinh thiết sẽ bị khử nước và khó có thể được cắt ra cho đến khi hoàn tất quá trình xử lý thích hợp.
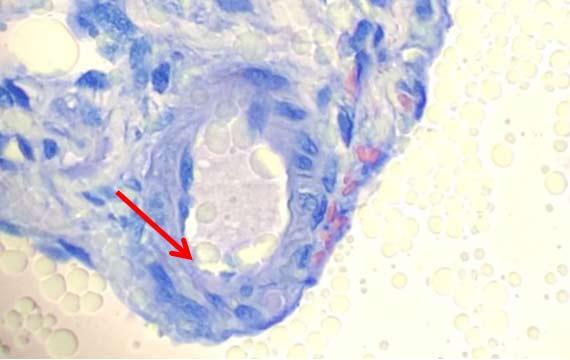
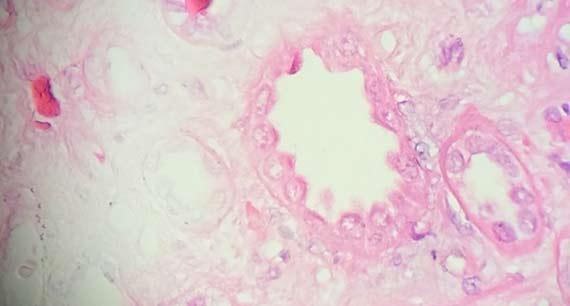
Bong bóng hạt nhân xảy ra khi các protein trong nhân đông lại. Hiện tượng này thường là kết quả của các mẫu được cố định kém và gặp phải nhiệt độ cao. Chất cố định có độ pH cao cũng có thể gây ra hiện tượng này. Môi trường khắc nghiệt khiến protein đông tụ xung quanh những giọt chất lỏng nhỏ, khiến chúng có hình dạng bong bóng.
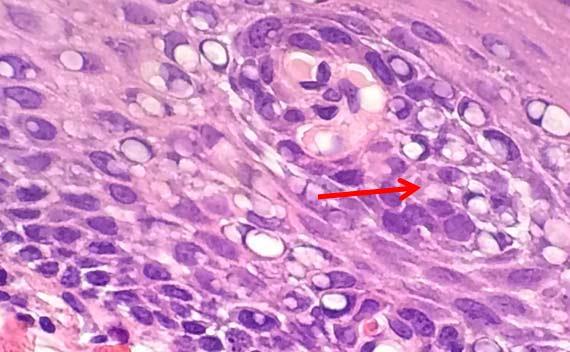
Sau khi cắt xong, các lam kính ướt thường được cho vào tủ sấy để làm khô. Nhiệt độ cao (ví dụ 70°C) có thể làm cho nước bên dưới lát cắt bay hơi nhanh qua mô. Sự bay hơi có thể làm cho protein đông lại, tạo ra hiện tượng bong bóng hạt nhân. Cách tốt nhất để tránh trường hợp này là giảm nhiệt độ lò hoặc để các lam kính khô một chút trước khi đặt chúng vào tủ sấy.
Cách để xác định nguồn gốc của các hạt nổi là xem chúng ở đâu trên tiêu bản so với mô. Nếu chúng nằm trong cùng mặt phẳng tiêu điểm với mẫu mô thì rất có thể chúng là chất gây ô nhiễm trong khối (trong quá trình vùi mô)
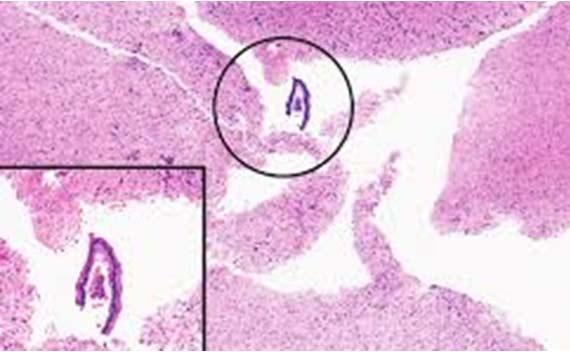
Ô nhiễm bên ngoài thường sẽ xuất hiện các hạt nổi phía trên mô hoặc ra khỏi mặt phẳng mô. Việc thường xuyên thay đổi và lọc thuốc thử là những phương pháp tốt nhất để tránh hiện tượng này.
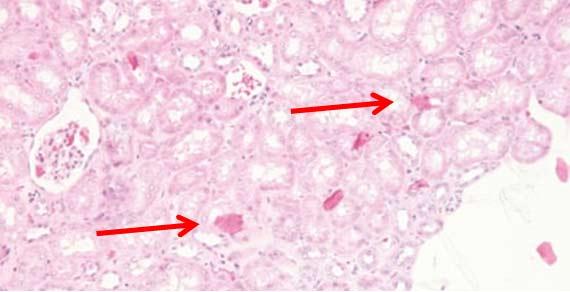
Vi khuẩn và nấm có thể phát triển trong máy nhuộm và bình thuốc thử nếu những khu vực này không được làm sạch thường xuyên. Thực hiện theo hướng dẫn của nhà sản xuất để bảo trì thiết bị.
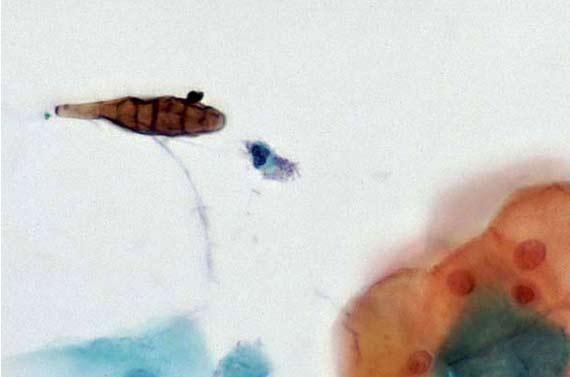
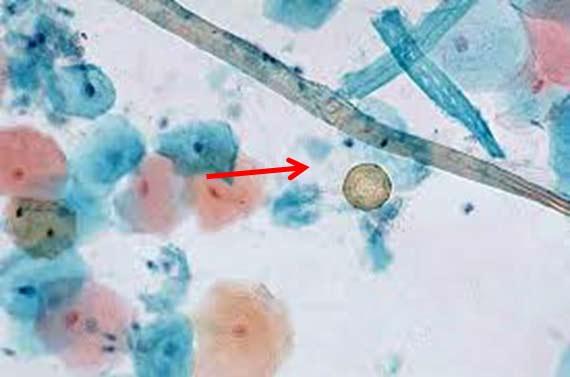
Melanin, hemosiderin và các phần ngoại lai có thể gây mất tập trung. Ngay cả các chất cố định cũng có thể tạo ra các sắc tố tế bào bổ sung, chẳng hạn như của Zenker, điều này có thể gây lo ngại nếu nhà nghiên cứu mô bệnh học không biết rằng mẫu đã được cố định trong một chất khác ngoài formalin. Trong khi Zenker’s (kali dicromat/thủy ngân clorua) phần lớn không được sử dụng do độc tính của nó, có một số nơi vẫn có thể tự sản xuất.
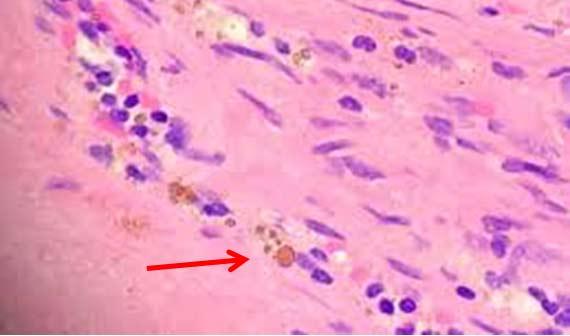
Trước đây, khi các lam kính tích điện được coi là quá tốn kém cho việc cắt lát thông thường, các phòng thí nghiệm đã dựa vào albumin hoặc các protein khác để giúp các mô bám vào các lam kính.
Chất kết dính có những hạn chế riêng và thậm chí có thể cản trở nhuộm hóa mô miễn dịch
Các chất thay thế Xylene hiện được bán rộng rãi và có thể cung cấp thêm lớp an toàn cho phòng thí nghiệm. Hãy nhớ rằng chúng có những hạn chế riêng, chẳng hạn như khả năng chịu nước thấp. Cũng có thể cần phải sử dụng chất kết dính tương thích theo khuyến nghị của nhà sản xuất, vì không phải tất cả chúng đều tương thích với gốc xylene thông thường.
Một trong những cách dễ nhất để giữ cho các tiêu bản nhuộm H&E chất lượng là chỉ cần đảm bảo thay thuốc thử thường xuyên.
Những điều chỉnh dưới đây sẽ tối ưu màu sắc khi nhuộm:
- Hematoxylin +/- 30 giây
- Eosin Y +/- 15 giây
Nguồn: https://www.leicabiosystems.com/knowledge-pathway/he-basics-part-4-troubleshooting-he/
Minh Khang là nhà phân phối và nhập khẩu trực tiếp các thiết bị Giải phẫu bệnh từ hãng Leica Biosystems.


 EN
EN