Liệu pháp tế bào CAR-T là phương pháp điều trị cá nhân hóa mang tính đột phá và có hiệu quả cao liên quan đến các tế bào T từ hệ thống miễn dịch của bệnh nhân, được biến đổi gen để nhắm mục tiêu và tiêu diệt các tế bào ung thư. Liệu pháp tế bào CAR-T được coi là phương án điều trị cuối cùng cho những bệnh nhân đáp ứng các tiêu chí cụ thể. Tuy nhiên, các thử nghiệm lâm sàng đã chứng minh rằng các liệu pháp này có thể được sử dụng và được khuyến nghị là phương pháp điều trị tuyến hai cho những bệnh nhân có tình trạng ung thư đã kháng với các liệu pháp truyền thống như hóa trị hoặc xạ trị hoặc khi bệnh của bệnh nhân tái phát. Tính đến năm 2023, liệu pháp tế bào CAR-T được chấp thuận sử dụng cho những cá nhân mắc một số loại u lympho không Hodgkin, bệnh bạch cầu lymphoblastic cấp tính tế bào B và bệnh đa u tủy. Mặc dù liệu pháp tế bào CAR-T đã cho thấy sự thành công đáng kể trong việc điều trị các bệnh ung thư máu cụ thể, nhưng các quy trình sản xuất hiện tại vẫn còn nhiều chỗ để cải thiện.
Giới thiệu
Liệu pháp tế bào CAR-T là phương pháp điều trị cá nhân hóa mang tính đột phá và có hiệu quả cao liên quan đến các tế bào T từ hệ thống miễn dịch của bệnh nhân, được biến đổi gen để nhắm mục tiêu và tiêu diệt các tế bào ung thư.
Liệu pháp tế bào CAR-T được coi là phương án điều trị cuối cùng cho những bệnh nhân đáp ứng các tiêu chí cụ thể. Tuy nhiên, các thử nghiệm lâm sàng đã chứng minh rằng các liệu pháp này có thể được sử dụng và được khuyến nghị là phương pháp điều trị tuyến hai cho những bệnh nhân có bệnh ung thư đã được chứng minh là kháng với các liệu pháp truyền thống như hóa trị hoặc xạ trị hoặc khi bệnh của bệnh nhân tái phát.
Tính đến năm 2023, liệu pháp tế bào CAR-T được chấp thuận sử dụng cho những cá nhân mắc một số loại u lympho không Hodgkin, bệnh bạch cầu lymphoblastic cấp tính tế bào B và bệnh đa u tủy. Điều kiện đủ để sử dụng liệu pháp tế bào CAR-T được xác định dựa trên bản chất của bệnh và tình trạng sức khỏe của bệnh nhân.
Một quá trình sản xuất đầy thử thách và độc đáo
Trong khi liệu pháp tế bào CAR-T đã cho thấy sự thành công đáng kể trong việc điều trị các bệnh ung thư máu cụ thể, các quy trình sản xuất hiện tại vẫn còn nhiều chỗ để cải thiện. Quy trình liệu pháp tế bào CAR-T tuân theo một hệ thống nhiều giai đoạn thường kéo dài vài tuần. Các giai đoạn sản xuất riêng lẻ cho các liệu pháp này, tất cả đều là các sản phẩm trên thị trường liệu pháp tự thân, cũng có thể đầy thách thức và phức tạp, đòi hỏi phải kiểm tra chất lượng nghiêm ngặt và thời gian ngắn. Các bước chính bao gồm:
Tách bạch cầu
Sau khi lấy máu từ bệnh nhân, các tế bào bạch cầu được tách khỏi các tế bào hồng cầu và các thành phần khác. Các tế bào bạch cầu chứa các tế bào T sẽ rất quan trọng cho sự phát triển của các tế bào CAR-T sau này. Sau khi thu thập các tế bào bạch cầu, máu còn lại được truyền trở lại cho bệnh nhân.
Kích hoạt tế bào T, chuyển hóa và mở rộng
Từ các tế bào bạch cầu thu thập được của bệnh nhân, các tế bào T được tinh chế và trải qua quá trình biến đổi di truyền tỉ mỉ, tiến triển qua các giai đoạn hoạt hóa, chuyển đổi và mở rộng. Các vectơ virus (lentivirus và/hoặc retrovirus) đóng vai trò quan trọng trong việc đưa vật liệu di truyền mong muốn vào tế bào T, chuyển đổi chúng thành các chiến binh CAR-T mạnh mẽ.
Công thức và vận chuyển
Các tế bào CAR-T được kích hoạt và mở rộng sau đó được bào chế trong môi trường thích hợp để tiêm, biến đổi thành một loại thuốc có tác dụng chống lại bệnh ung thư máu. Sản phẩm cuối cùng chỉ được phát hành sau khi được kiểm tra theo các tiêu chuẩn kiểm soát chất lượng nghiêm ngặt.
Về vận chuyển, trong trường hợp sản xuất tập trung, có thể có những lo ngại về hậu cần với việc bảo quản lạnh hoặc vận chuyển sản phẩm cuối cùng. Ngược lại, các mô hình sản xuất phi tập trung cho phép giảm thiểu rủi ro vận chuyển và tính ổn định của sản phẩm do bảo quản lạnh.
Truyền tế bào CAR-T
Các tế bào CAR-T được tăng cường trở lại nhóm lâm sàng và được truyền cho bệnh nhân qua đường truyền tĩnh mạch. Quá trình truyền dịch chuyển đổi này đánh dấu đỉnh cao của một quá trình phức tạp kéo dài nhiều tuần. Bây giờ, liệu pháp đã sẵn sàng để giải phóng tiềm năng của nó trong cơ thể bệnh nhân.
Một trong những yếu tố quan trọng nhất ảnh hưởng đến kết quả điều trị của bệnh nhân trong liệu pháp tế bào CAR-T là thời gian ‘vein-to-vein’, tức là khoảng thời gian giữa lúc thu thập tế bào T (ly giải bạch cầu) và lúc truyền sản phẩm CAR-T.
Đối với tất cả các sản phẩm được FDA Hoa Kỳ chấp thuận, phải mất từ ba đến năm tuần để sản xuất và đánh giá chất lượng trước khi sản phẩm sẵn sàng sử dụng. Các sản phẩm tế bào CAR-T có trên thị trường được sản xuất tại một cơ sở sản xuất tập trung cụ thể, hướng đến thời gian hoàn thành là 16–33 ngày. Tuy nhiên, khung thời gian này dễ bị chậm trễ và tỷ lệ thất bại dao động từ 1 đến 18%.
Thời gian sản xuất kéo dài có liên quan đến khả năng suy giảm tiềm tàng về hiệu lực của tế bào CAR-T, như được chỉ ra trong các nghiên cứu như nghiên cứu do Saba Ghassemi và cộng sự thực hiện vào năm 2018. Sự suy giảm hiệu lực này làm dấy lên mối lo ngại về việc ảnh hưởng đến tác động điều trị của tế bào CAR-T được đưa vào.
Ngoài ra, thời gian ‘‘vein-to-vein’ cũng bị ảnh hưởng bởi các bước khác như vận chuyển đến nơi bệnh nhân, xét nghiệm theo quy định, quy trình bảo hiểm và các khía cạnh hoạt động rộng hơn, tất cả những yếu tố này cùng nhau có ý nghĩa quan trọng đối với bệnh nhân mắc bệnh tiến triển.
Thời gian chờ đợi thường khiến bệnh nhân phải trải qua các liệu pháp bắc cầu bổ sung, có thể làm tăng nguy cơ tác dụng phụ và biến chứng. Do đó, việc cung cấp phương pháp điều trị cho bệnh nhân càng nhanh càng tốt là rất quan trọng vì tình trạng lâm sàng của bệnh nhân có thể xấu đi rất nhanh và bất kỳ sự chậm trễ nào cũng có thể gây hại cho cơ hội sống sót của bệnh nhân. Khoảng thời gian hiện tại cho thời gian ‘vein-to-vein’ là vấn đề, đặc biệt đối với những bệnh nhân ở giai đoạn tiến triển của bệnh, vì nó có thể ảnh hưởng đến khả năng đủ điều kiện của họ để điều trị CAR-T
Vì tất cả các sản phẩm CAR-T đều là tự thân, một thông số quan trọng khác là chuỗi nhận dạng. Để duy trì chuỗi nhận dạng, việc dán nhãn và theo dõi vật liệu, từ việc thu thập bạch cầu cho đến việc quản lý tế bào CAR-T, phải được ghi chép cực kỳ đầy đủ để tránh việc quản lý cho bệnh nhân một lô sản phẩm CAR-T sai.
Tầm quan trọng của việc thử nghiệm an toàn trong CAR-T
Trong quá trình sản xuất liệu pháp tế bào CAR-T, nhiều xét nghiệm được tiến hành trong suốt quá trình, từ giai đoạn đầu đến khi phát hành cuối cùng của liệu pháp. Điều quan trọng là phải ưu tiên tính an toàn để giảm thiểu rủi ro liên quan đến các liệu pháp này, đặc biệt là ô nhiễm. Các xét nghiệm thiết yếu này bao gồm xét nghiệm mycoplasma, xét nghiệm vô trùng và thử giới hạn nhiễm khuẩn, giám sát môi trường và phát hiện nội độc tố
Kiểm tra Mycoplasma
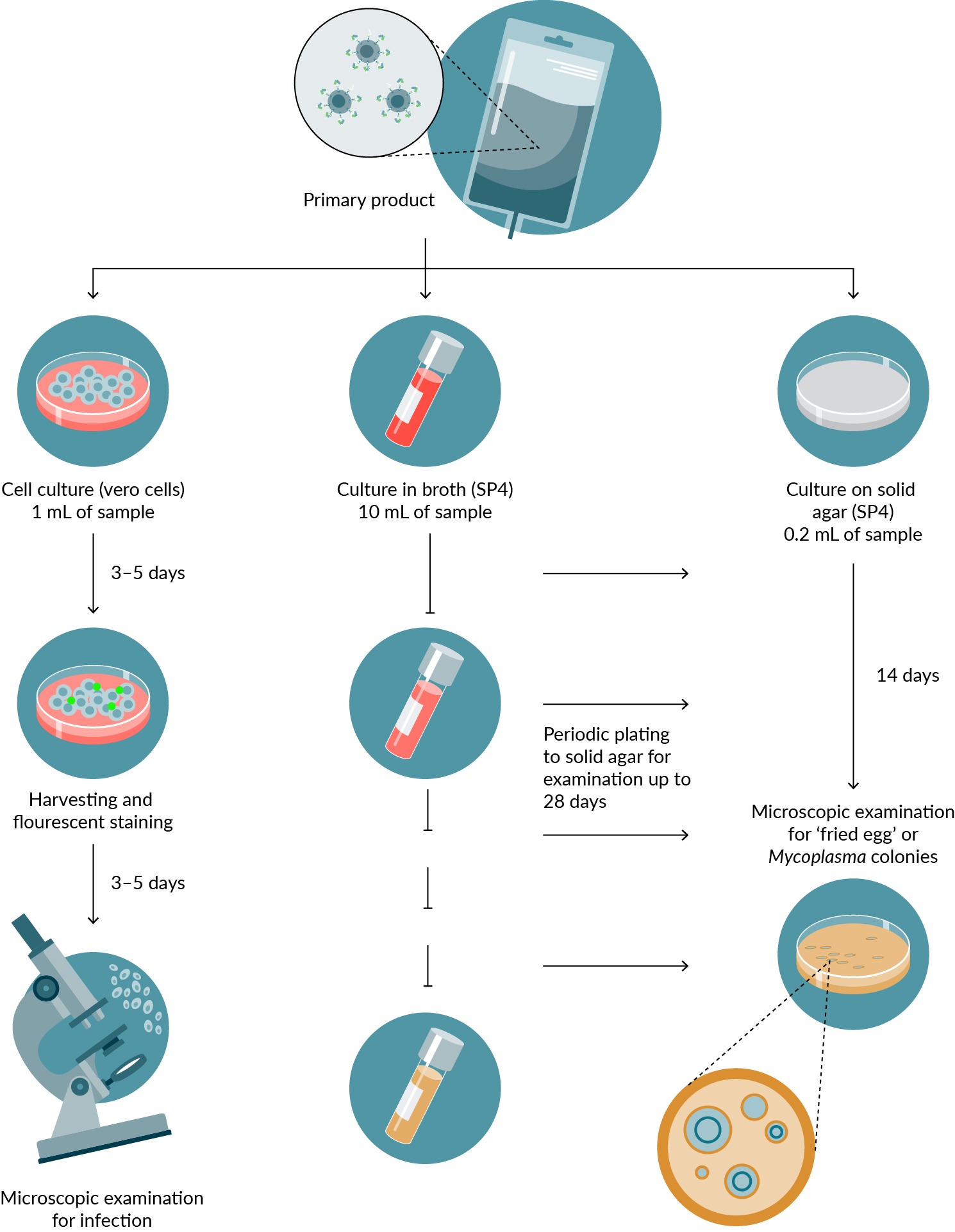
Xét nghiệm Mycoplasma là một đánh giá quan trọng để phát hiện sự hiện diện của mycoplasma, một loại vi khuẩn có thể làm nhiễm bẩn nuôi cấy tế bào và có khả năng ảnh hưởng đến chất lượng và độ an toàn của các sản phẩm điều trị. Đảm bảo không có mycoplasma là điều cần thiết để duy trì tính toàn vẹn của sản phẩm và sự an toàn của bệnh nhân;
Nhiễm Mycoplasma đặt ra thách thức đáng kể trong quá trình phát triển và sản xuất các sản phẩm sinh học, có khả năng gây tổn hại đến các sản phẩm tế bào và tính an toàn của dược phẩm sinh học. Các cơ quan quản lý trên toàn thế giới yêu cầu phải thử nghiệm mycoplasma trong quá trình phát triển và sản xuất. Các công ty dược phẩm sinh học tiến hành thử nghiệm mycoplasma phải tuân thủ Chương USP <63> Xét nghiệm Mycoplasma của Dược điển Hoa Kỳ (USP) và Dược điển Châu Âu (EP) Chương 2.6.7
Phương pháp truyền thống có thời gian quay vòng là 28 ngày. Làm cho xét nghiệm này trở nên quan trọng. Các phương pháp dựa trên xét nghiệm axit nucleic được phép và cho kết quả trong vòng một giờ đến vài giờ.
Kiểm tra vô trùng
Kiểm tra vô trùng bao gồm việc đánh giá sự vắng mặt của các vi sinh vật có thể sống trong sản phẩm và xác minh rằng sản phẩm không chứa bất kỳ loại vi khuẩn, nấm men hoặc nấm mốc có khả năng gây hại nào;
Tính vô trùng là tối quan trọng trong sản xuất liệu pháp tế bào CAR-T. Bất kỳ sự nhiễm khuẩn nào cũng có thể dẫn đến phản ứng bất lợi nghiêm trọng ở bệnh nhân, khiến việc thử nghiệm tính vô trùng trở nên quan trọng đối với tính an toàn của sản phẩm;
Các công ty dược phẩm sinh học tiến hành thử nghiệm vô trùng phải tuân thủ Chương USP <71> Thử nghiệm vô trùng của Dược điển Hoa Kỳ (USP) và Dược điển Châu Âu (EP) Chương 2.6.1, trong đó nêu rõ thời gian xử lý không dưới 14 ngày. Tuy nhiên, các phương pháp vi sinh vật học nhanh thay thế được phép sử dụng để giảm thời gian thử nghiệm vô trùng.
Các thử nghiệm này đóng vai trò quan trọng trong việc kiểm soát chất lượng sản xuất liệu pháp tế bào CAR-T, đảm bảo sản phẩm cuối cùng không chứa các chất gây ô nhiễm có hại, do đó duy trì tính an toàn và hiệu quả của phương pháp điều trị.
Quy trình công nghiệp ngày càng phát triển
Liệu pháp tế bào CAR-T là các sản phẩm truyền dịch tươi có thời hạn sử dụng hạn chế, đặt ra những thách thức độc đáo đối với các phương pháp thử nghiệm vi sinh truyền thống (xét nghiệm vô trùng trong 14 ngày, xét nghiệm mycoplasma trong 28 ngày), ban đầu được thiết kế cho các ứng dụng ít nhạy với thời gian hơn. Để đáp ứng nhu cầu cấp thiết về việc cung cấp liệu pháp nhanh chóng cho bệnh nhân, các nhà sản xuất liệu pháp tế bào CAR-T đã triển khai một quy trình công nghiệp đang phát triển liên quan đến:
Tăng cường số hóa và tự động hóa: sự chuyển dịch theo hướng số hóa và tự động hóa mạnh mẽ hơn này rất quan trọng để tối ưu hóa năng lực sản xuất, giảm chi phí và tạo ra dữ liệu có giá trị;
Giảm thời gian xử lý: các nhà sản xuất đang tìm cách sử dụng các phương pháp nhanh chóng và tính mô-đun để đẩy nhanh quá trình sản xuất và thời gian thử nghiệm phát hành, đảm bảo bệnh nhân nhận được liệu pháp nhanh hơn;
Cải thiện thiết bị: việc đơn giản hóa và cải tiến thiết bị nhằm mục đích giảm sự phức tạp trong việc sản xuất liệu pháp tế bào CAR-T.
Xem xét kỹ hơn về nơi mà các quy trình sản xuất CAR-T có thể được điều chỉnh thêm, những người tiên phong trong ngành như Kite Pharma gần đây đã thừa nhận sự cần thiết của các phương pháp kiểm soát chất lượng nhanh chóng và nhấn mạnh tầm quan trọng của việc tham gia QC sớm vào giai đoạn thiết kế và phát triển. Các chuyên gia tại công ty đã đề xuất giám sát và phát triển sớm các phương pháp có tỷ lệ không hợp lệ thấp, cùng với các khoản đầu tư sớm vào các phương pháp nhanh chóng và các công nghệ lab-in-a-pouch sáng tạo, để sử dụng trong các quy trình như xét nghiệm mycoplasma.
Các chuyên gia từ Viện Ung thư Dana-Farber cũng nhấn mạnh đến sự cần thiết của xét nghiệm mycoplasma khi phát hành sản phẩm và nhu cầu giải quyết những thách thức hiện tại trong việc đảm bảo an toàn sản phẩm. Để ứng phó, viện đang khám phá các phương pháp xét nghiệm có thể hoàn thành trong vòng chưa đầy 5 phút, không cần đào tạo phòng xét nghiệm nâng cao, nơi có kết quả trong vòng chưa đầy một giờ và giảm nguy cơ nhiễm bẩn.
Bối cảnh thay đổi của sản xuất liệu pháp tế bào CAR-T xuất hiện để đáp ứng nhu cầu ngày càng tăng về dịch vụ chăm sóc bệnh nhân nhanh chóng và hiệu quả. Được thúc đẩy bởi tính cấp thiết trong việc cung cấp quyền truy cập kịp thời vào các phương pháp điều trị mang tính chuyển đổi này, các nhà nghiên cứu và lãnh đạo ngành đang cải tiến các quy trình sản xuất (ví dụ: ‘Cell Shuttle’ của Cellares, nền tảng của OriBiotech) để tối ưu hóa hiệu quả và đảm bảo nhiều bệnh nhân hơn có thể được hưởng lợi từ Liệu pháp tế bào CAR-T một cách nhanh chóng. Với cam kết này, các nhà sản xuất đang tìm cách chuyển đổi việc cung cấp dịch vụ chăm sóc sức khỏe, nhấn mạnh vào tính nghiêm ngặt và khả năng tiếp cận khoa học.
Giải quyết khoảng cách kỹ năng trong liệu pháp tế bào và gen
Một thách thức khác mà các nhà sản xuất các liệu pháp phức tạp này phải đối mặt là tình trạng thiếu hụt hiện tại của những công nhân lành nghề trong các lĩnh vực quan trọng có ý nghĩa quyết định đối với việc sản xuất, thử nghiệm và cung cấp các phương pháp điều trị sáng tạo này. Tình trạng thiếu hụt này mở rộng sang các vai trò sản xuất, phát triển phân tích, thử nghiệm và kiểm soát chất lượng.
Một trong những rào cản quan trọng nhất để giải quyết tình trạng thiếu hụt lực lượng lao động này là chi phí đào tạo. Mặc dù đào tạo thực hành trong phòng thí nghiệm là điều cần thiết để thành công trong lĩnh vực này, nhưng nó cũng có thể tốn kém một cách vô lý. Cả những ứng viên có nguyện vọng gia nhập ngành và những nhà giáo dục muốn cung cấp chương trình đào tạo có liên quan đều phải đối mặt với những thách thức liên quan đến chi phí. Việc triển khai thiết bị và dụng cụ tự động là một giải pháp tiềm năng để thu hẹp khoảng cách lực lượng lao động này. Việc sử dụng rộng rãi hơn các loại tiến bộ công nghệ này có thể hỗ trợ đáng kể cho ngành trong việc giải quyết tình trạng thiếu hụt nhân sự có tay nghề và chi phí đào tạo liên quan.
Tiềm năng của liệu pháp tế bào CAR-T là gì?
Tương lai của liệu pháp tế bào CAR-T được đánh dấu bằng những nỗ lực liên tục nhằm hợp lý hóa và đẩy nhanh việc cung cấp phương pháp điều trị an toàn, hiệu quả và chất lượng cho bệnh nhân(Hình 3). Các ví dụ về việc triển khai thành công các mốc thời gian ngắn hơn có thể được đưa ra bởi quy trình sản xuất 3 ngày của Đại học Pennsylvania, T-charge của Novartis và các nền tảng sản xuất ngày hôm sau của Gracell Biotechnologies.
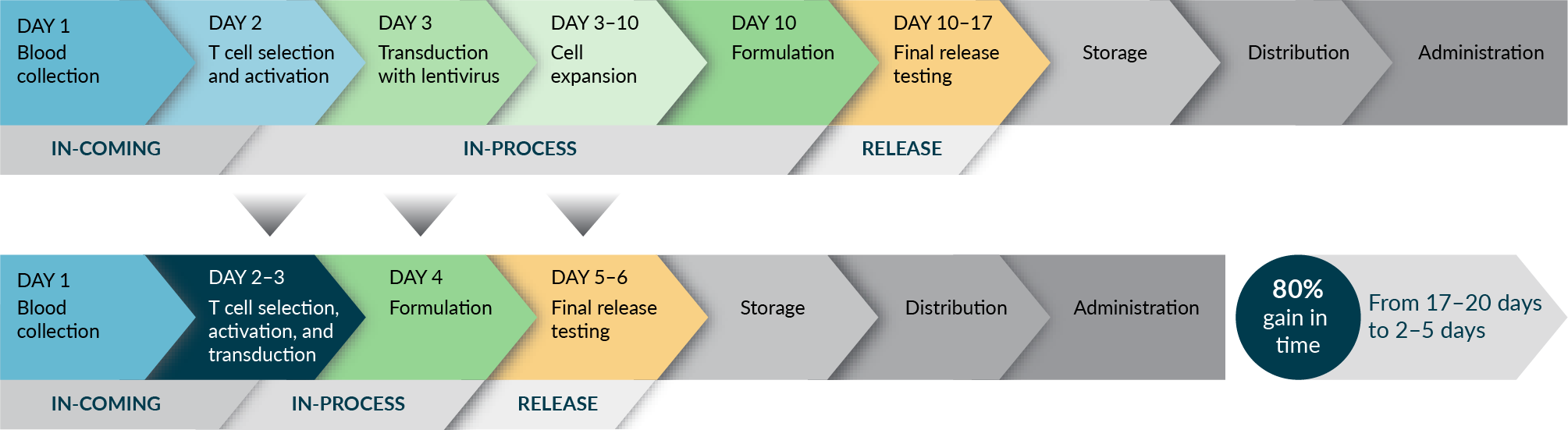
Các nhà sản xuất đang tích cực khám phá các chiến lược để giảm thiểu thời gian ‘vein-to-vein’, nhưng vẫn duy trì hiệu quả của các sản phẩm này và sử dụng các giải pháp mới để giải quyết các thách thức khác, chẳng hạn như khối lượng sản xuất thấp, thời hạn sử dụng sản phẩm ngắn, xử lý nguyên liệu thô phức tạp, theo dõi và tính toàn vẹn của dữ liệu, khả năng mở rộng và nhu cầu của bệnh nhân.
Ngoài ra, bản chất đẩy nhanh của quá trình sản xuất ngắn hơn đòi hỏi phải cảnh giác cao hơn đối với:
Kiểm tra vô trùng nhanh. Dược điển đang phát triển các chương mới (USP <1071> [Xét nghiệm vi sinh nhanh để giải phóng các sản phẩm vô trùng có thời hạn sử dụng ngắn: Phương pháp tiếp cận dựa trên rủi ro], USP <72> [Phương pháp vi sinh dựa trên hô hấp để phát hiện ô nhiễm trong các sản phẩm có thời hạn sử dụng ngắn] và EP 2.6.27 [Kiểm tra vi sinh các chế phẩm dựa trên tế bào]) để giúp giải phóng các sản phẩm có thời hạn sử dụng ngắn như liệu pháp tế bào CAR-T bằng các phương pháp vi sinh nhanh hiện đại;
Khả năng tồn tại của vectơ lentivirus, chẳng hạn như thử nghiệm lentivirus có khả năng sao chép;
Và cuối cùng, việc kiểm soát số lượng bản sao vectơ có khả năng làm thay đổi biểu hiện của gen tế bào và góp phần gây ung thư.
Một giải pháp đầy tiềm năng cung cấp các giải pháp tiết kiệm chi phí, Liệu pháp CAR-T thế hệ tiếp theo kết hợp với công nghệ chỉnh sửa gen CRISPR-Cas9 và tế bào CAR-T được tạo ra trong cơ thể sống bằng cách sử dụng các hạt nano chứa mRNA mã hóa cho gen CAR. Mặc dù ở giai đoạn đầu, dữ liệu tiền lâm sàng cho thấy hệ thống phân phối nano cho tế bào CAR-T trong cơ thể có triển vọng tối ưu hóa hiệu quả và tổng chi phí của chúng. Trong thập kỷ qua, liệu pháp tế bào CAR-T đã có những tiến bộ đáng kể với nhiều sản phẩm có sẵn để sử dụng trong lâm sàng.
Sự tập trung của ngành vào số hóa, tự động hóa và các phương pháp xét nghiệm nhanh phản ánh cam kết của ngành trong việc cung cấp cho bệnh nhân quyền truy cập kịp thời vào phương pháp điều trị này. Khi lĩnh vực này tiếp tục phát triển, liệu pháp CAR-T hứa hẹn là một phương pháp tiếp cận mang tính chuyển đổi đối với việc điều trị ung thư, mang lại hy vọng mới cho nhiều bệnh nhân có ít sự lựa chọn điều trị bệnh.
Công ty Minh Khang là nhà phân phối độc quyền giải pháp Dược phẩm hãng bioMérieux (Pháp).


 EN
EN