Việc phát hiện nội độc tố từ lâu đã phụ thuộc vào phương pháp Limulus Amebocyte Lysate (LAL) và đang được xem xét áp dụng với Chương USP <86>. LAL đã từng loại bỏ nhu cầu thử nghiệm trên thỏ vì lợi ích khoa học. Vì vậy, yếu tố C tái tổ hợp (rFC) đang trở thành tiêu chuẩn thử nghiệm nội độc tố mới. Sau 20 năm kinh nghiệm với rFC, các lập luận khoa học đã tích lũy để hỗ trợ cụ thể việc chọn rFC để phát hiện nội độc tố từ góc độ của bốn loại chính: tính đặc hiệu, đặc tính hiệu suất thử nghiệm, tính gây nhiễu và tính dễ sử dụng.
Tính đặc hiệu
LAL bao gồm một loại enzyme dẫn đến tạo ra phản ứng dương tính giả (yếu tố G), trong khi rFC được thiết kế để phát hiện cụ thể nội độc tố.
Tính đặc hiệu là một thuộc tính quan trọng trong kiểm tra nội độc tố. Vào những năm 1980, sự kích hoạt β (1,3) Glucan của Yếu tố G đã được phát hiện, chứng minh rằng LAL không còn đặc hiệu cho nội độc tố. rFC chỉ chứa Yếu tố C chứ không phải Yếu tố G và do đó không thể phản ứng với beta-glucans.
Các loại chất phản ứng LAL khác đã được xác định từ những năm 1980, bao gồm vật liệu xenlulo từ các bộ lọc dược phẩm, polynucleotide, một số protein và mannan cũng như các loại gạc y tế và bộ lọc máu. Gần đây hơn, beta-glucans đã được nhìn thấy trong liệu pháp tế bào và các sản phẩm thành phần máu sử dụng bộ lọc xenlulo khử trùng.
Hiệu suất thử nghiệm nội độc tố
Một số mẫu khó kiểm tra hoặc thể hiện sự thay đổi lớn khi sử dụng LAL, so với rFC, điều này mang lại lợi thế về độ chính xác, độ chính xác và độ lặp lại.
LAL đến từ máu của động vật hoang dã bao gồm các độ tuổi, kích cỡ, giới tính khác nhau và các yếu tố khác. Sự biến đổi liên quan đến các lô LAL khác nhau là do tính không đồng nhất trong quá trình thu hoạch và chiết xuất của sam. Việc sản xuất rFC tổng hợp có nghĩa là có ít sự khác biệt giữa các lô và kết quả rFC nhất quán ngay cả từ nhà cung cấp này sang nhà cung cấp khác.
Tính nhất quán cao của rFC có nghĩa là sản phẩm được thử nghiệm ở Trung Quốc có thể giống hệt với thử nghiệm được thực hiện ở Mỹ. Một nghiên cứu lớn của một tập đoàn các nhà sản xuất dược phẩm đã chỉ ra rằng khi sử dụng các quy trình tiêu chuẩn hóa, các xét nghiệm rFC có thể thu được kết quả nhất quán ở nhiều phòng thí nghiệm khác nhau.

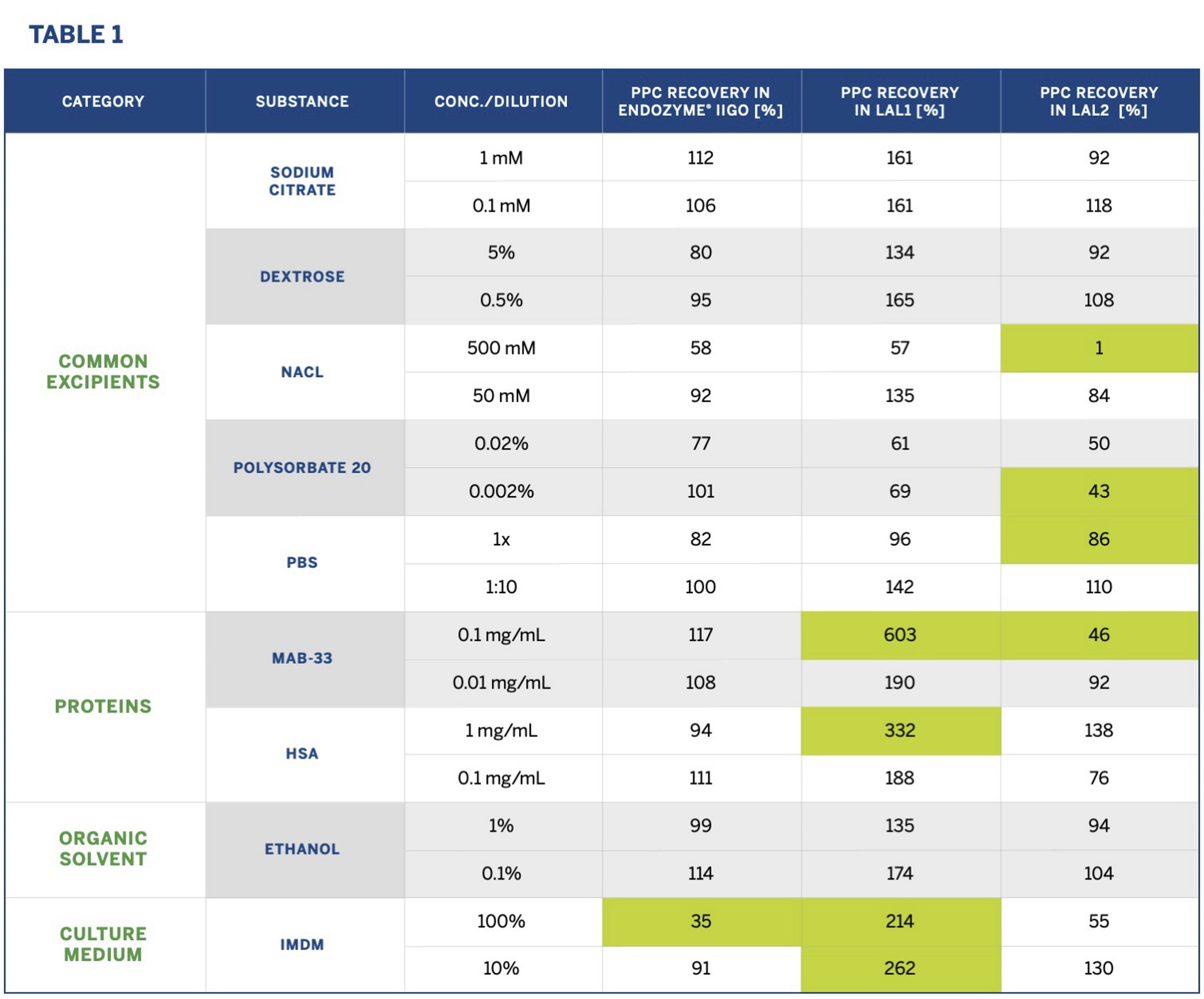
Chất gây nhiễu
Dễ sử dụng
Việc sử dụng các đĩa đã thêm chuẩn cho phép người dùng bỏ qua việc chuẩn bị đường chuẩn CSE, bước trộn pipet, pha loãng và đổ đĩa, cũng như thêm các giếng mẫu riêng lẻ (với các phần 10mL).
Các đĩa ENDOZYME® II GO được bổ sung sẵn đường chuẩn CSE và giếng mẫu PPC, giúp dễ sử dụng và giảm thiểu lỗi trong phòng thí nghiệm

Việc chuyển từ LAL sang rFC cho thấy những lợi ích đáng kể bao gồm tính đặc hiệu, hiệu suất xét nghiệm, tính gây nhiễu và tính dễ sử dụng. Thử nghiệm nội độc tố vi khuẩn hiệu quả ngày nay cũng phải bao gồm các cân nhắc về môi trường và đảm bảo chuỗi cung ứng. Khi xem xét lựa chọn phát hiện nội độc tố, điều quan trọng là phải giảm thiểu rủi ro liên quan đến việc sử dụng các phương pháp thiếu dữ liệu và kinh nghiệm. Với rFC, bioMérieux với 20 năm kinh nghiệm đảm bảo sẽ mang lại giải pháp hiệu quả nhất đến khách hàng.
Minh Khang là nhà phân phối độc quyền các sản phẩm kiểm tra vi sinh vật hãng bioMérieux (Pháp).



 EN
EN