Một trong những cải tiến trong phân tích mô bệnh học hiện nay là kỹ thuật nhuộm ghép đa kênh. Bài viết dưới đây sẽ mô tả quá trình chẩn đoán ung thư và nêu rõ tầm quan trọng của nhuộm ghép đa kênh để chẩn đoán ung thư.
Quá trình chẩn đoán ung thư từ sinh thiết mô
Mặc dù các bệnh ung thư phát sinh từ mỗi vị trí trên cơ thể con người nhưng hai khối u không giống nhau. Việc chẩn đoán ung thư ngày nay đòi hỏi phải quan sát cẩn thận hình thái tế bào và mô trong từng khối u. Bước đầu tiên là thu thập sinh thiết, một mảnh mô khối u để nhà nghiên cứu bệnh học có thể soi tế bào dưới kính hiển vi. Sinh thiết có thể bao gồm từ một bộ sưu tập mô rất nhỏ thu được bằng kim cho đến khối lượng rất lớn được cắt bỏ do phẫu thuật. Việc chẩn đoán khối u là ung thư và loại nào không đơn giản, mô phải trải qua hàng trăm bước riêng lẻ để có thể quan sát dưới kính hiển vi. Ban đầu, mô được “cố định” trong formalin để bảo quản cấu trúc của nó. Mô cố định này sau đó được vùi parafin để cho phép xử lý, lưu trữ và xử lý đơn giản hóa. Sau đó, mô được cắt thành các phần mỏng và dán trên các phiến kính, sau đó có thể được nhuộm màu để minh họa các đặc điểm hoặc phân tử cụ thể trong tế bào và mô.
Thuốc nhuộm đầu tiên thường là thuốc nhuộm hematoxylin và eosin (H&E), ban đầu được sử dụng trong ngành dệt may. H&E là chất nhuộm 2 màu làm nổi bật cấu trúc tổng thể của tế bào và là tiêu chuẩn toàn cầu để chẩn đoán mô. Sau đó, nhà nghiên cứu bệnh học sẽ xác định những thuốc nhuộm bổ sung nào có thể cần thiết để đưa ra chẩn đoán. Đó là ung thư biểu mô, khối u tế bào biểu mô hay ung thư hạch, khối u tế bào bạch huyết? Nhuộm mô hóa “đặc biệt” cũng sử dụng thuốc nhuộm dệt, nhưng các loại thuốc nhuộm hiện đại chính sử dụng đầu dò phân tử để xác định và dán nhãn các loại phân tử cụ thể trong mô: hóa mô miễn dịch (IHC) sử dụng kháng thể để xác định protein hoặc carbohydrate, trong khi lai tại chỗ (ISH) sử dụng axit nucleic để xác định axit nucleic bổ sung (DNA hoặc RNA).
Chẩn đoán ung thư vào năm 2020 thường bao gồm một số vết phân tử để xác định loại khối u chính xác. Có thể cần phải nhuộm thêm để chẩn đoán hoàn chỉnh và dự đoán liệu pháp điều trị trúng đích nào có thể mang lại cho bệnh nhân sự sống lâu nhất hoặc cơ hội sống sót cao nhất. Vì nhiều lý do, bao gồm cả 3R – nhanh chóng, tin cậy và tiết kiệm – phần lớn các thuốc nhuộm bổ sung là đơn sắc, được thực hiện bằng cách áp một đầu dò duy nhất vào một phần (lát) mô riêng biệt và sử dụng một màu duy nhất để hình dung sự phân bố của nó trong mô. Trong các trường hợp phức tạp, tổng số lượng nhuộm màu có thể vượt quá 20, mỗi loại nhuộm cần một lát mô riêng biệt. Mặc dù các lát mô rất mỏng, việc sử dụng nhiều lát như vậy có thể gây lãng phí, đặc biệt nếu mô còn cần thiết cho các xét nghiệm chẩn đoán khác. Bác sĩ giải phẫu bệnh sau đó phải tự tích hợp từng loại nhuộm màu riêng lẻ để tạo ra hình ảnh đa màu của khối u của bệnh nhân.
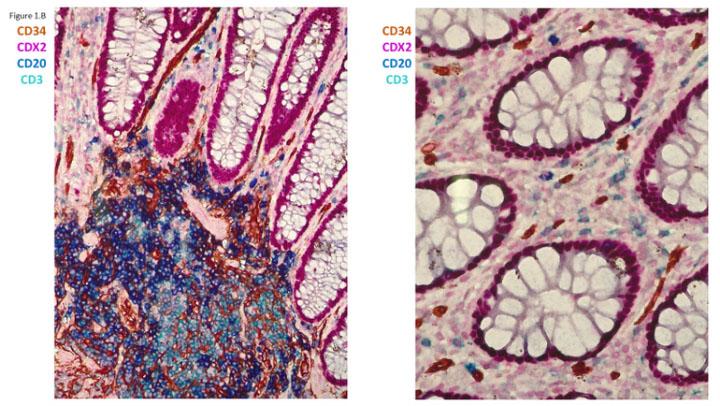
Xu hướng nhuộm ghép đa kênh
Ngày nay, nhuộm ghép đa kênh thường được thực hiện trong nghiên cứu để hiểu chi tiết về các mẫu mô, nhưng do sự kết hợp của các yếu tố kỹ thuật, vận hành và tài chính nên hiếm khi được thực hiện trong phòng thí nghiệm chẩn đoán lâm sàng như một phần của chẩn đoán ung thư. Ghép đa kênh cung cấp nhiều lợi thế tiềm năng để đưa ra chẩn đoán ung thư bao gồm:
- Bảo quản mô. Chẩn đoán và điều trị ung thư phổi đã có những tiến bộ nhanh chóng trong thập kỷ qua, nhưng hầu hết bệnh nhân ung thư phổi không thể phẫu thuật khi họ bị ung thư. Vì những lý do này, ung thư phổi thường được chẩn đoán bằng sinh thiết kim, tạo ra một mẫu rất nhỏ. Tính đến giữa năm 2020, có chín bất thường phân tử khác nhau trong bệnh ung thư phổi liên quan đến các liệu pháp điều trị trúng đích, mỗi loại yêu cầu một xét nghiệm riêng và sử dụng một lát mô riêng biệt. Ngoài ra, một số xét nghiệm yêu cầu gửi một số lát mô đến phòng thí nghiệm tham chiếu lớn hoặc cơ sở cốt lõi để thực hiện giải trình tự thế hệ tiếp theo (NGS). Việc áp dụng phương pháp nhuộm ghép đa kênh để chẩn đoán ung thư phổi có thể giúp bảo quản mô để đảm bảo chẩn đoán chính xác được thực hiện mà không cần phải sinh thiết lại.
- Cải thiện độ chính xác chẩn đoán. Chẩn đoán ung thư tuyến tiền liệt thường bao gồm việc kiểm tra hơn chục mẫu sinh thiết bằng kim, chẩn đoán và lựa chọn liệu pháp điều trị của bệnh nhân phụ thuộc rất nhiều vào việc xác định loại, mức độ và kích thước của ung thư trong suốt quá trình sinh thiết. Trong khi một số tế bào ung thư tuyến tiền liệt có thể dễ dàng nhận ra khi sinh thiết thì những tế bào khác có thể có dạng như tế bào lành tính. Kỹ thuật nhuộm nhiều lớp PIN4 kết hợp các dấu hiệu trong tế bào tuyến tiền liệt lành tính và ác tính để có thể nhìn thấy cả hai loại tế bào trong cùng một phần bằng cách sử dụng các màu sắc khác nhau, giúp nhà nghiên cứu bệnh học chẩn đoán ung thư tuyến tiền liệt một cách đáng tin cậy
- Nâng cao cái nhìn sâu sắc chẩn đoán. Khi chúng ta tìm hiểu thêm về cách các khối u phát triển và cách các liệu pháp mới có thể ngăn chặn sự phát triển của chúng, ghép đa kênh sẽ là một kỹ thuật thiết yếu để hình dung các yếu tố này trong mỗi khối u. Ví dụ, một thế hệ thuốc mới, chất ức chế điểm kiểm soát miễn dịch, ngăn chặn khả năng của khối u nhằm ngăn hệ thống miễn dịch của bệnh nhân chống lại khối u. Mặc dù vẫn còn nhiều điều cần tìm hiểu nhưng người ta ngày càng nhận ra rằng các đặc điểm của các tế bào miễn dịch khác nhau trong khối u, bao gồm cả vị trí và trạng thái kích hoạt của chúng, ảnh hưởng đến cách thức hoạt động của các chất ức chế điểm kiểm soát. Ví dụ, các tế bào lympho trong khối u có thể ở trạng thái “kích hoạt” hoặc “biệt hóa”, mỗi trạng thái này có thể được nhìn thấy trong mỗi tế bào bằng cách biểu hiện các protein với màu nhuộm khác nhau . Các khối u thường thu hút các tế bào không phải khối u được gọi là tế bào ức chế bắt nguồn từ myeloid (MDSC) để ngăn chặn phản ứng miễn dịch chống khối u tại cụm u. Cuối cùng, phần lớn đã được nghiên cứu về cách các quần thể đại thực bào khác nhau, các tế bào biệt hóa của cơ thể, có thể hỗ trợ và do đó đóng vai trò trái ngược nhau trong sự phát triển của khối u. Trong khi hai chức năng này được quy cho hai loại đại thực bào, được gọi là M1 hoặc M2, những quan sát gần đây cho thấy không phải hai mà là chín loại đại thực bào khác nhau trong cơ thể! Hiện tại, không có quan sát nào trong số này được sử dụng trong chẩn đoán thường quy cho bệnh nhân ung thư vì chúng chưa được chứng minh là có ảnh hưởng đến tiên lượng hoặc lựa chọn liệu pháp, nhưng nghiên cứu phổ biến gần đây cho chúng ta biết chúng cực kỳ quan trọng.
Hãy xem xét tính đơn giản của phương pháp tiếp cận chẩn đoán ung thư hiện nay liên quan đến độ phức tạp tuyệt đối của mô ung thư. Có thể thấy, độ phức tạp của một tế bào đơn lẻ, có đường kính chỉ bằng 1/100 milimet. Mỗi tế bào người bình thường chứa khoảng hai thước DNA, ba tỷ cặp bazơ, mã hóa ~21.000 gen, mỗi gen có thể tạo ra nhiều RNA khác nhau. Trong một tế bào điển hình tại bất kỳ thời điểm nào cũng có hơn một triệu RNA điều khiển quá trình tổng hợp hàng triệu phân tử protein. Ung thư là căn bệnh từ DNA; những thay đổi trong DNA gây ra những thay đổi về protein làm thay đổi cấu trúc tế bào cũng như chức năng của các cơ quan trong tế bào khối u dẫn đến sự phát triển không kiểm soát của khối u.
Các tế bào ung thư biểu hiện nhiều bất thường, phức tạp và không đồng nhất hơn nhiều so với các tế bào không ung thư. Tuy nhiên, vào năm 2020 để chẩn đoán ung thư, Leica Biosytems vẫn chỉ kiểm tra một loại phân tử (axit nucleic hoặc protein) trong mỗi phần mô. Các kỹ thuật nghiên cứu phổ biến liên quan đến việc phát hiện các dấu hiệu bằng huỳnh quang hoặc khối phổ có thể tăng số lượng phân tử quan sát được cùng một lúc lên gấp 10 lần so với các kỹ thuật truyền thống và kỹ thuật phân tích tế bào đơn có thể định lượng hàng nghìn phân tử khác nhau trong mỗi tế bào. Lượng dữ liệu có thể được trích xuất từ một khối u là rất lớn, tuy nhiên hầu hết dữ liệu đó đều không liên quan đến chẩn đoán của bệnh nhân. Các nhà nghiên cứu bệnh học tin rằng điều quan trọng là phải quan sát các phân tử trong các phần mô để đưa ra chẩn đoán tốt nhất. Ghép đa kênh có thể giải quyết vấn đề hiển thị đúng tập hợp phân tử trong phần mô của mỗi bệnh nhân.
Thách thức của kỹ thuật ghép đa kênh trong lâm sàng
Nhuộm ghép đa kênh cũng có rào cản đối với việc thực hiện chăm sóc lâm sàng, bao gồm nhu cầu xác nhận xét nghiệm rộng rãi, tăng thời gian chạy xét nghiệm, chi phí thuốc thử so với số lượng thuốc nhuộm đơn sắc tương đương và sự hạn chế kỹ thuật viên có kỹ năng thực hiện và giải thích các xét nghiệm. Quá trình xác thực của kỹ thuật ghép đa kênh phải bao gồm so sánh với thí nghiệm monoplex, điều này không chỉ đòi hỏi các yêu cầu xác thực tăng lên mà còn đòi hỏi các giải pháp kỹ thuật số và tính toán để loại bỏ lỗi. Trong khi các xét nghiệm IHC&ISH lần đầu tiên được thực hiện thủ công, sự ra đời của máy nhuộm robot tự động vào những năm 1990 đã làm giảm thời gian thực hiện xét nghiệm đồng thời cải thiện khả năng tái lập. Các giao thức nhuộm ghép đa kênh tự động hiện tại thường mất nhiều thời gian hơn so với các quy trình nhuộm đơn sắc tương đương. Chi phí thuốc thử vẫn là một thách thức, mặc dù Leica Biosystems dự đoán việc áp dụng rộng rãi hơn sẽ giảm chi phí về lâu dài.
Ghép đa kênh có được thực hiện bằng bệnh lỹ kỹ thuật số không?
Ngoài ra còn có những thách thức xung quanh việc giải thích thí nghiệm tăng theo số lượng điểm được đo tại một thời điểm. Bởi vì các nhà nghiên cứu bệnh học đã quen với việc giải thích các vết nhuộm đơn thường dán nhãn cho một loại tế bào hoặc ngăn mô, nên việc giải thích vết nhuộm hai điểm đánh dấu hoặc vết triplex (ba điểm đánh dấu) thường không khó hơn việc giải thích một tập hợp các vết đơn phức nếu mỗi vết đánh dấu không bị chồng chéo lên nhau. Trong nhiều trường hợp, việc quan sát đồng thời hai hoặc nhiều điểm đánh dấu trong cùng một phần sẽ mang lại giá trị gia tăng. Tuy nhiên, nếu có hai hoặc nhiều phân tử hiện diện trong cùng một ngăn hoặc mô tế bào và số lượng phân tử trong tế bào là quan trọng để đánh giá trạng thái của nó. Hãy hình dung 30 hoặc 3000 phân tử trên mỗi tế bào! Rõ ràng, cần có các chương trình máy tính giúp phân tích hình ảnh để giải thích. Ngày nay, chúng ta đang nhanh chóng bước vào thời đại “bệnh lý kỹ thuật số”, trong đó việc giải thích các mô của bệnh nhân sẽ tối ưu hơn là bằng kính hiển vi truyền thống. Với việc áp dụng bệnh lý kỹ thuật số sẽ xuất hiện các “ứng dụng” bao gồm định lượng phân tử và trí tuệ nhân tạo sẽ giúp nhà nghiên cứu bệnh học giải thích các bộ dữ liệu phức tạp mà các vết nhuộm ghép đa kênh có thể tạo ra.
Tầm nhìn của kỹ thuật ghép đa kênh
Những tiến bộ trong điều trị ung thư ngày càng liên quan đến những bất thường về phân tử cụ thể trong bệnh ung thư của mỗi bệnh nhân, điều này dẫn đến quá trình sinh thiết của mỗi bệnh nhân trở nên phức tạp hơn. Khi số lượng phân tử cần điều tra trong sinh thiết ung thư tiếp tục tăng, Leica Biosystems tin rằng phương pháp ghép đa kênh sẽ đóng vai trò quan trọng trong phân tích sinh thiết bằng cách tối đa hóa việc sử dụng mô hạn chế, cải thiện độ chính xác chẩn đoán và nâng cao hiểu biết sâu sắc về chẩn đoán, cũng như đóng vai trò là công cụ dự đoán tốt hơn về tiên lượng và hướng dẫn lựa chọn điều trị. Ngoài những tiến bộ trong công nghệ nhuộm màu, việc áp dụng đầy đủ công nghệ ghép đa kênh sẽ đòi hỏi các công cụ kỹ thuật số, tính toán và cuối cùng là trí tuệ nhân tạo để hỗ trợ các chẩn đoán và các liệu pháp cá nhân hóa.

Minh Khang là nhà phân phối và nhập khẩu trực tiếp các thiết bị Giải phẫu bệnh từ hãng Leica Biosystems.


 EN
EN