Tóm tắt
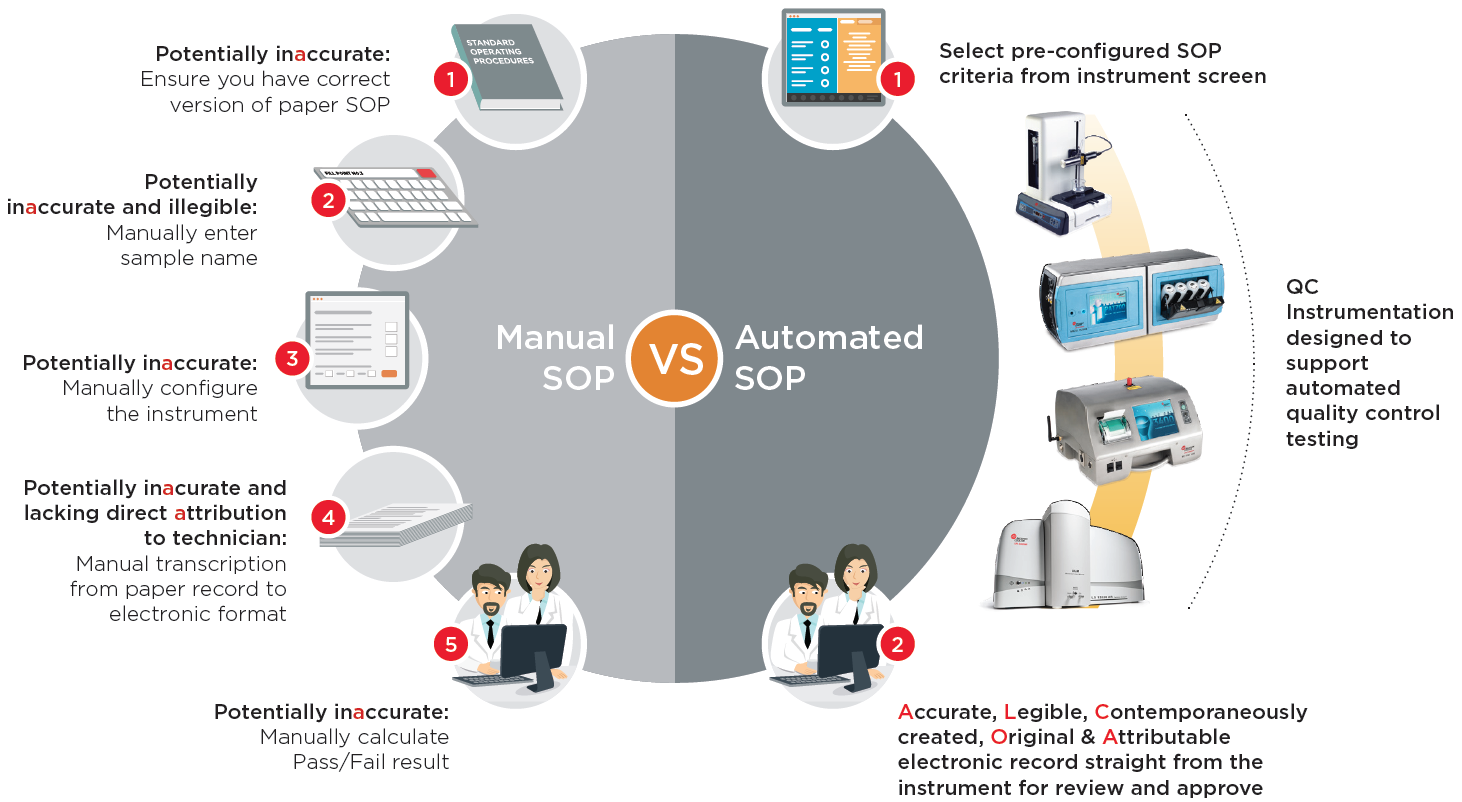
Một báo cáo cho thấy rằng trung bình các nhà máy sản xuất dược phẩm chi khoảng $40M mỗi năm cho việc kiểm soát chất lượng (QC). Đồng thời, một báo cáo khác cho biết rằng 79% trong tổng số 483 Thư cảnh báo do FDA ban hành năm 2016 đã trích dẫn các vấn đề về tính toàn vẹn dữ liệu 21 CFR Phần 11. Đào tạo là nội dung phổ biến trong Thư cảnh báo 483 của FDA, tuy nhiên, nó chỉ là một phần trong giải pháp: vấn đề chỉ là công nhân đã không tuân thủ đúng SOP, hay SOP thủ công không đủ mạnh để ngăn chặn sự tái diễn của vấn đề trong tương lai? Bất kỳ quy trình nào tự động hóa SOP kiểm soát chất lượng đều có khả năng vừa giảm tác động do lỗi của con người đối với các vấn đề về tính toàn vẹn của dữ liệu, vừa mang lại khoản tiết kiệm đáng kể bằng cách giảm thời gian mà các kỹ thuật viên cần dành để thực hiện SOP.
Bài viết này xem xét bốn quy trình kiểm soát chất lượng phổ biến và cách tự động hóa có thể giúp cải thiện tính toàn vẹn của dữ liệu bằng cách giảm khả năng xảy ra lỗi của con người, đồng thời tiết kiệm thời gian và giảm chi phí vận hành.
Giới thiệu
FDA đã đưa ra rất nhiều khuyến nghị trong sáng kiến PAT năm 2004, nhiều quy trình kiểm tra kiểm soát chất lượng (QC) thông thường trong ngành dược phẩm vẫn còn rất thủ công và tốn thời gian. Một nghiên cứu của Phòng thí nghiệm Phát triển Sinh học Công nghiệp cho thấy >20% kết quả thử nghiệm có sự khác biệt trong 16 kỹ thuật viên QC có kinh nghiệm thực hiện cùng một SOP thủ công. Rõ ràng là SOP thủ công có thể được cải thiện và các kỹ thuật viên được đào tạo, nhưng sự thay đổi về kết quả như vậy cho thấy rằng quy trình thủ công không đủ để cung cấp các mức độ kiểm soát chất lượng cần thiết. Mặc dù các thông số kỹ thuật của thiết bị tương tự có thể tương đương nhau, nhưng khi tìm cách cải thiện việc kiểm soát chất lượng, các nhóm QC nên xem xét mức độ tự động hóa trong thiết bị để thực hiện kiểm tra QC hiệu quả hơn và có thể tái lập được. Ví dụ, một nguồn lỗi phổ biến trong thử nghiệm QC là chuẩn bị mẫu. Một thiết bị tự động hóa quy trình chuẩn bị mẫu có thể mang lại khả năng tái tạo và độ ổn định cao hơn cho xét nghiệm QC.
Ngoài ra, theo sáng kiến PAT của FDA, người dùng có thể cân nhắc chuyển từ việc dựa hoàn toàn vào thử nghiệm QC tại phòng thí nghiệm sang sử dụng thiết bị QC Online để thay thế. Ví dụ: nhiều công ty đã xác nhận thiết bị kiểm tra chất lượng nước Online trên các vòng lặp Nước tinh khiết (PW) và Nước pha tiêm (WFI), nhưng họ vẫn tiếp tục dựa vào kiểm tra nước trong phòng thí nghiệm tốn nhiều thời gian để kiểm tra việc xuất xưởng sản phẩm. Miễn là các công cụ Online có thể được xác nhận và đáp ứng các yêu cầu của dược điển, thì ít nhất nên giảm số lượng thử nghiệm trong phòng thí nghiệm và thay vào đó dựa vào dữ liệu từ các công cụ Online. Vì các công cụ Online được tự động hóa nên việc sử dụng sẽ giúp quá trình thử nghiệm hiệu quả hơn bằng cách tránh lỗi của con người, do đó cải thiện tính toàn vẹn của dữ liệu, đồng thời giảm chi phí QC.
Nước tinh khiết và nước cho việc kiểm tra chất lượng QC
TOC và độ dẫn điện là hai trong số bốn thuộc tính chất lượng quan trọng được xác định cho WFI và PW trong Dược điển Hoa Kỳ . Máy phân tích Online như Máy Phân Tích Tổng Carbon Hữu Cơ (TOC) ANATEL PAT700 có thể được xác thực để tuân thủ đầy đủ cả hai thuộc tính chất lượng chính này theo các yêu cầu của dược điển.
Sáng kiến Công nghệ Phân tích Quy trình (PAT) của FDA khuyến khích ngành dược phẩm đầu tư vào thiết bị kiểm soát quy trình Online để đảm bảo kiểm soát chất lượng trong quy trình thay vì phụ thuộc quá nhiều vào thử nghiệm chất lượng sản phẩm cuối cùng. Chất lượng ngay từ lần đầu tiên đối với sản xuất theo lô được khuyến khích vì thử nghiệm sản phẩm cuối cùng đối với dược phẩm không thể thực hiện thử nghiệm 100% lô – một sai sót trong quá trình lấy mẫu và thử nghiệm và toàn bộ lô có thể bị hủy. Để đạt được điều này, nhiều nhà sản xuất dược phẩm đang kết nối máy phân tích TOC Online với hệ thống kiểm soát tại nhà máy để có thể sử dụng bất kỳ hoạt động TOC hoặc phát hiện khi độ dẫn điện cao để tạm dừng sản xuất và ngăn ngừa khả năng nước bị ô nhiễm có thể bị trộn lẫn với các thành phần dược phẩm có giá trị.
Với việc sửa đổi chương WFI của Dược điển Châu Âu (EP) hiện cho phép sản xuất WFI từ quá trình thẩm thấu ngược (RO) và siêu lọc 12 lần, TOC và giám sát độ dẫn điện của các hệ thống nước dược phẩm ngày càng có ý nghĩa quan trọng do nhận thức được nguy cơ ô nhiễm tiềm ẩn trong hệ thống RO so với hàng rào an toàn do nước tĩnh tạo ra.
4 thuộc tính chất lượng nước của FDA đối với PW và WFI là:
- Vô cơ
- Hữu cơ
- Nội độc tố
- vi sinh vật
Trong hướng dẫn, FDA muốn nhấn mạnh rằng 21 CFR Phần 11 chỉ áp dụng cho lịch sử dữ liệu nơi lưu giữ hồ sơ điện tử. Mối nguy hiểm với các công cụ Online được tích hợp lịch sử dữ liệu cục bộ riêng là chúng có thể đáp ứng đầy đủ các yêu cầu của phán quyết 21 CFR Phần 11. Các máy phân tích như PAT700 tránh được vấn đề này bằng cách cho phép vô hiệu hóa lịch sử dữ liệu cục bộ, do đó đảm bảo rằng nó không đáp ứng đầy đủ yêu cầu 21 CFR Phần 11 dưới dạng kho lưu trữ dữ liệu cho hồ sơ điện tử.
Thông thường, dữ liệu từ các máy phân tích TOC Online được lưu trữ trong các hệ thống Kiểm soát giám sát và thu thập dữ liệu (SCADA) hoặc Hệ thống kiểm soát phân tán (DCS) đã được xác thực, khiến cho việc cải tiến kiểm soát quy trình trở nên khó khăn và bổ sung thêm một lượng kiểm soát thay đổi đáng kể. Các phương pháp tiếp cận hiện đại hơn lưu giữ các bản ghi dữ liệu quan trọng có chất lượng trong một kho lưu trữ an toàn riêng biệt, khiến các hệ thống SCADA và DCS chỉ dành riêng cho việc kiểm soát quy trình và nhanh nhẹn hơn. Để hỗ trợ điều này, PAT700 có thể được cấu hình để tự động gửi các bản ghi điện tử PDF qua FTP an toàn qua Ethernet để xem xét và phát hành hàng loạt, do đó đáp ứng các yêu cầu của ALCOA đối với các bản ghi điện tử là dễ đọc và nguyên bản.
Không giống như thiết bị kiểm tra chất lượng nước trong phòng thí nghiệm sử dụng thuốc thử và yêu cầu cấu hình thủ công cho từng mẫu và hiệu chuẩn thường xuyên, thường là hàng ngày, PAT700 Online không yêu cầu thuốc thử, tự động hóa quy trình thử nghiệm và chỉ yêu cầu hiệu chuẩn 12 tháng một lần. Các SOP kiểm tra tính phù hợp của hệ thống và hiệu chuẩn được tự động hóa, không yêu cầu nhập dữ liệu thủ công và các báo cáo đạt/không đạt được tạo tự động mà không cần tính toán thủ công.

Giám sát môi trường phòng sạch định kỳ
GMP yêu cầu các điều kiện chất lượng không khí để sản xuất dược phẩm sinh học trong phòng sạch. Trên thực tế, mối nguy hiểm thực sự là các vi khuẩn trên cơ thể con người. Con người thải ra khoảng 30.000 tế bào da mỗi giờ, tất cả đều là những vật mang vi khuẩn tiềm ẩn. Tuy nhiên, hiện tại Beckman Coulter không có công nghệ để phát hiện vi khuẩn trong không khí theo thời gian thực, vì vậy các thiết bị phân tích hạt trong không khí được sử dụng làm công cụ thay thế.

Các cuộc thảo luận tại các cơ sở trên khắp thế giới nêu bật xu hướng ngày càng tăng khi thách thức thực hiện giám sát môi trường đang chuyển từ nhóm vi sinh QC sang nhân viên sản xuất, vì hai lý do: a) thuê nhân viên vi sinh tương đối tốn kém để thực hiện các nhiệm vụ thường xuyên như vậy và b) giảm số lượng người bên trong phòng sạch, do đó giảm khả năng nhiễm bẩn sản phẩm. Bên cạnh đó là đội ngũ sản xuất không có cùng trình độ kiến thức về giám sát môi trường định kỳ.
Trong các nhà máy sản xuất dược phẩm sinh học lớn hơn, có thể có các nhóm gồm 10 kỹ thuật viên trở lên có nhiệm vụ lấy hàng nghìn mẫu giám sát môi trường định kỳ hàng tháng. Tại mỗi địa điểm lấy mẫu, họ phải nhập thủ công tên địa điểm vào quầy trước khi bắt đầu lấy mẫu. Bộ đếm phải được cấu hình thủ công theo các SOP đã viết. Vào cuối mỗi ngày, bản in ra giấy từ mỗi vị trí mẫu phải được sao chụp vì máy in trong máy đếm hạt là nhiệt và bản in sẽ mờ dần theo thời gian. Sau đó, kết quả từ mọi vị trí phải được chuyển từng cái một theo cách thủ công sang định dạng điện tử.
Hướng dẫn sử dụng SOP giám sát môi trường phòng sạch định kỳ
| Điểm tiếp xúc 1 |
Điểm tiếp xúc 2 |
Điểm tiếp xúc 3 |
Điểm tiếp xúc 4 |
Điểm tiếp xúc 5 |
| • Đảm bảo đúng SOP • Đọc hiểu SOP |
Nhập thủ công từng tên vị trí mẫu | Định cấu hình bộ đếm theo cách thủ công: • Thời gian lấy mẫu • Số lượng mẫu • Lấy trung bình kết quả • Hệ số nhân chính xác cho m3 |
In ra giấy và photocopy | Sao chép kết quả theo cách thủ công |
Trong nỗ lực cải thiện tính toàn vẹn của dữ liệu, một số nhà sản xuất đã tối ưu hóa thiết bị phân tích hạt dành riêng cho việc sử dụng QC dược phẩm, tích hợp vào thiết kế thiết bị khả năng cho các SOP điện tử được cấu hình sẵn bao gồm:
- Thiết lập và cấu hình thiết bị
- Báo cáo pass-fail tự động theo tiêu chí của GMP
- Tạo bản ghi điện tử 21 CFR Phần 11 trực tiếp từ thiết bị
Người dùng chỉ cần chọn SOP điện tử đã được định cấu hình sẵn trong thiết bị và nhấn nút ‘Start’ và thiết bị sẽ tự cấu hình chính xác theo SOP, thực hiện kiểm tra chính xác và tạo bản ghi kết quả kiểm tra điện tử, tất cả đều tự động. Điều này không chỉ cải thiện tính toàn vẹn của dữ liệu mà còn có thể giảm chi phí vì các kỹ thuật viên không còn phải mất thời gian đối chiếu hồ sơ giấy và chuyển dữ liệu sang hồ sơ điện tử theo cách thủ công. Ngoài ra, bằng cách loại bỏ việc sử dụng máy phân tích hạt không khí thông qua các SOP tự động, quy trình này tạo điều kiện chuyển trách nhiệm giám sát môi trường phòng sạch định kỳ từ các nhà vi sinh học có trình độ sang nhân viên sản xuất, giúp giảm chi phí.
Thu gọn quy trình giám sát môi trường định kỳ với SOP điện tử
Thủ công
| Điểm tiếp xúc 1 |
Điểm tiếp xúc 2 |
Điểm tiếp xúc 3 |
Điểm tiếp xúc 4 |
Điểm tiếp xúc 5 |
| Thủ công | Nhập thủ công tên vị trí | Cấu hình bộ đếm thủ công | Chuyển dữ liệu thủ công | Xem xét và phê duyệt |
SOP điện tử
| Điểm tiếp xúc 1 |
Điểm tiếp xúc 2 |
|||
| Chọn SOP được cấu hình sẵn từ màn hình bộ đếm |  MET ONE 3400+ Giám sát môi trường Đếm hạt trong không khí |
Xem xét và phê duyệt kết quả trong Excel, PDF hoặc XML | ||
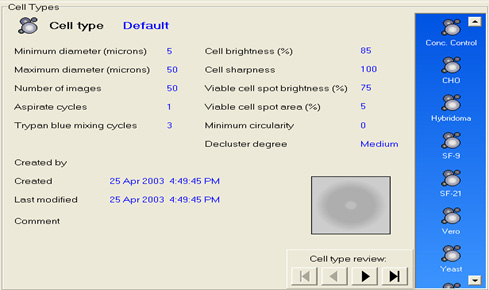
Đếm tế bào sống
Các sản phẩm trị liệu tế bào ở dạng quần thể tế bào đồng nhất thường được liệt kê về nồng độ và khả năng tồn tại dựa trên tế bào có thể nhuộm mô sống như xanh lam trypan. Điều này được thực hiện thủ công bằng cách sử dụng kính hiển vi và huyết cầu kế, nhưng phương pháp này có thể vừa tốn thời gian vừa dễ bị lỗi. Được thiết kế ban đầu để đếm các tế bào máu, thể tích mẫu được sử dụng thường chỉ là 100 nanolit và các sai số nhỏ khi sử dụng phương pháp này do kỹ thuật viên gây ra trong quá trình pha loãng mẫu, trộn, dùng pipet và đếm có thể dẫn đến sai số lớn trong kết quả cuối cùng, kết quả đếm được nhân lên để báo cáo nồng độ tế bào theo số lượng khả thi/mL.
Chương USP <1046> chỉ ra rằng các máy đếm tế bào và khả năng tồn tại tự động có thể cung cấp độ chính xác cao hơn và phép liệt kê có thể lặp lại nhiều hơn. Những cải tiến này là tối ưu nếu giai đoạn chuẩn bị mẫu được tự động hóa, do đó giảm khả năng xảy ra lỗi của kỹ thuật viên. Ngoài ra, nếu bộ đếm tế bào tự động có thể sử dụng các thư viện SOP đếm tế bào điện tử, được lập trình sẵn phù hợp với các SOP thủ công để đếm tế bào do người dùng thiết kế, thì kết quả có nhiều khả năng chính xác và có thể lặp lại được. Cùng với việc cải thiện độ chính xác và khả năng tái tạo, bộ đếm tế bào tự động có thể giảm chi phí cho xét nghiệm QC này bằng cách cho phép kỹ thuật viên thực hiện các nhiệm vụ khác trong khi bộ đếm tự động hóa các giai đoạn chuẩn bị và đếm cho từng mẫu. Bộ đếm có thể đếm từ các đĩa 96 giếng có thể tiết kiệm đáng kể thời gian của kỹ thuật viên, do đó giảm chi phí QC. Bên cạnh đó, phương pháp tự động hóa các SOP đếm ô và tạo bản ghi điện tử, tính toàn vẹn của dữ liệu được cải thiện vì kết quả có thể quy cho, dễ đọc, được tạo đồng thời, nguyên gốc và chính xác theo Hướng dẫn của FDA về ALCOA trong tài liệu hướng dẫn 21 CFR Phần 11.
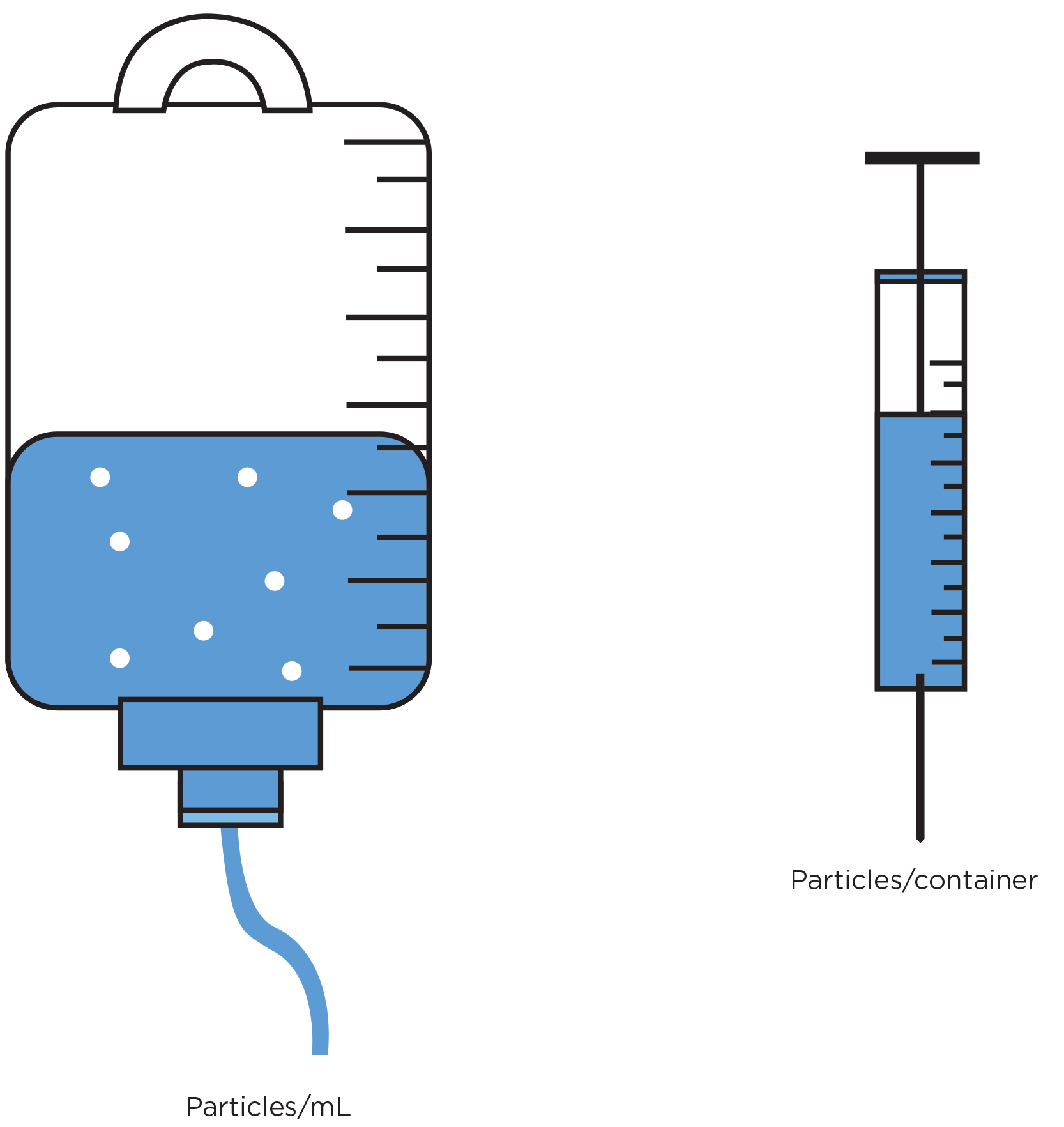
Thử nghiệm sản phẩm cuối cùng của thuốc tiêm
Thể tích mẫu được phân tích và định dạng báo cáo kết quả khác nhau tùy theo sản phẩm, ví dụ: yêu cầu lấy mẫu đối với sản phẩm protein trị liệu thể tích nhỏ, chẳng hạn như vắc-xin, khác với yêu cầu lấy mẫu thể tích lớn ngoài đường tiêu hóa như vắc-xin, túi tiêm tĩnh mạch. Các kết quả phải được tính toán và thể hiện ở định dạng chính xác, ví dụ: số đếm trên mỗi bể chứa hoặc số đếm trên mỗi mL, tùy thuộc vào sản phẩm được thử nghiệm.
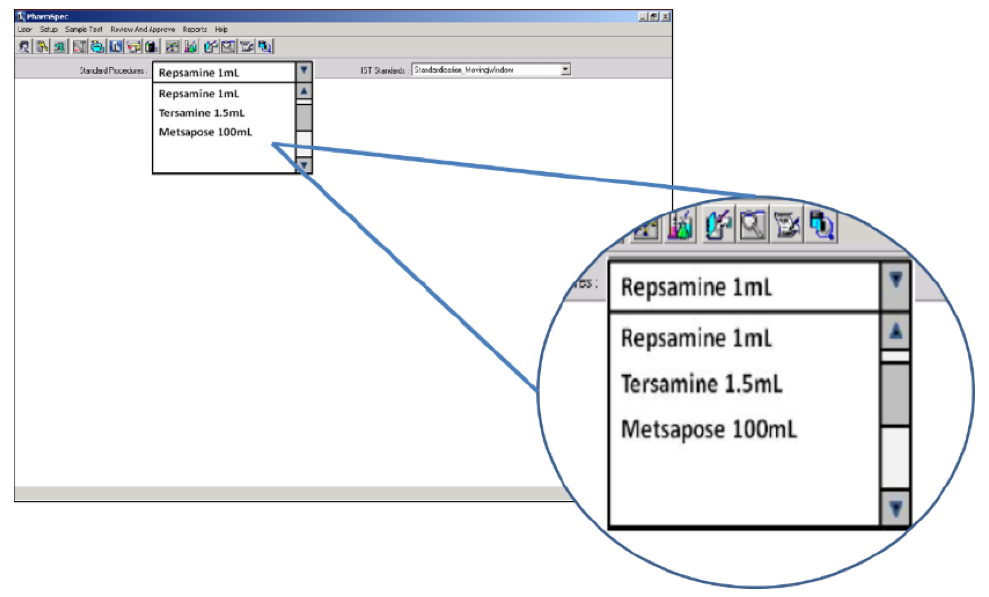
Mặc dù thiết bị đếm hạt chất lỏng đa năng có thể được sử dụng để kiểm tra hạt trong các sản phẩm dùng ngoài đường tiêu hóa, nhưng máy đếm đã được tối ưu hóa cho ứng dụng được ưu tiên hơn do có nhiều mức độ phức tạp trong thử nghiệm. Máy phân tích hạt đã được tối ưu hóa cho thử nghiệm này và được tích hợp sẵn các thử nghiệm tổng hợp khác nhau và sẽ tự động tính toán kết quả đạt/không đạt. Bộ đếm hạt cho phép người dùng chọn thử nghiệm cần thiết cho từng mẫu bằng cách chọn sản phẩm theo tên từ menu thả xuống.
Kết luận
Các SOP thủ công không đủ mạnh để ngăn chặn các lỗi và thiếu sót dữ liệu. Thiết bị QC tự động hóa SOP kiểm soát chất lượng có khả năng vừa giảm tác động do lỗi của con người đối với các vấn đề về tính toàn vẹn của dữ liệu, vừa mang lại khoản tiết kiệm chi phí đáng kể, tiết kiệm thời gian.
Minh Khang là nhà nhập khẩu và phân phối trực tiếp thiết bị giám sát môi trường hãng Beckman Coulter.



 EN
EN