Tips để thực hành kỹ thuật lai tại chỗ (ISH)
In Situ Hybridization (ISH) là một kỹ thuật lai tại chỗ cho phép định vị chính xác một đoạn axit nucleic cụ thể trong một phần mô. Thực hiện tốt trong mỗi bước sẽ giúp khắc phục sự cố khi xảy ra kết quả không khả quan, cho việc thực hành mô học tốt nhất. Tips thực hành ISH hiệu quả hơn được nêu rõ trong hướng dẫn dưới đây
1. Sử dụng các phần cắt chất lượng cao
Đặc biệt cẩn thận khi sử dụng các phần mỏng, phẳng đã được làm khô hoàn toàn trên lam kính. Sử dụng các tiêu bản tích điện cho ISH.
Các phần cắt không đồng đều, kết dính kém nhuộm màu không đều, các tín hiệu huỳnh quang không đặc hiệu.
2. Lai tại chỗ đảm bảo Cố định mô tối ưu
Cố định mô tốt bằng cách sử dụng các điều kiện cố định nhất quán (loại cố định, pH, nhiệt độ, thời gian) sẽ tạo ra kết quả tốt nhất.
Các điều kiện cố định không nhất quán, tạo ra các mô có kết quả khác nhau và gây khó khăn cho việc khắc phục sự cố.
3. Tránh các vấn đề về sự kết dính của phần cắt
Tránh sử dụng chất kết dính phần dựa trên protein trong bể tuyển nổi (keo, tinh bột hoặc gelatin), đặc biệt là trên các lam kính tích điện.
Chất kết dính dựa trên protein có thể chặn bề mặt của lam kính tích điện. Điều này gây ra sự kết dính không nhất quán và dẫn đến nhuộm màu không đều do thuốc thử ISH tập trung bên dưới các phần căng ra.
4. Tối ưu hóa loại bỏ sáp và ứng dụng hoá chất
Đặc biệt cẩn thận với việc khử sáp và khử nước ở các phần cũng như phân bố đồng đều và hiệu quả thuốc thử trên bề mặt mẫu thử. Điều này đảm bảo kết quả nhuộm đều và nhất quán.
Việc loại bỏ sáp không hoàn toàn có thể tạo ra các vùng không nhuộm màu hoặc nhuộm màu kém trong các phần. Bong bóng được giữ lại trên bề mặt của phần trong quá trình tiền xử lý hoặc nhuộm màu có thể gây ra ảnh hưởng.
5. Chọn đầu dò hiệu quả
Chọn đầu dò hiệu quả làm tăng độ nhạy và độ đặc hiệu
“Chỉ dựa đầu dò dựa trên giá cả.”
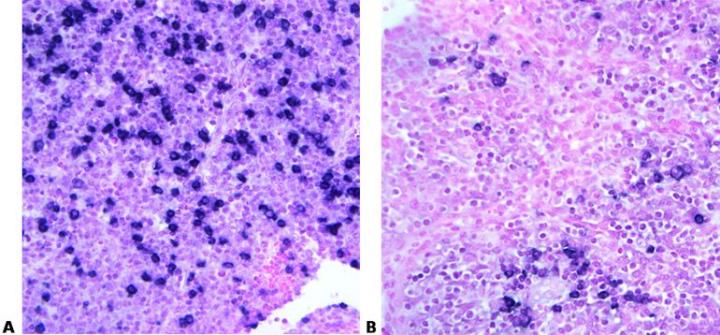
6. Đọc thông số kỹ thuật
Luôn kiểm tra bảng thông số kỹ thuật để xác định phương pháp phù hợp với một đầu dò cụ thể. Kiểm soát kỹ càng nhiệt độ và thời gian để cung cấp các điều kiện lai tối ưu.
Không có quyền truy cập vào các bảng dữ liệu trong phòng thí nghiệm: “Làm theo phương pháp tiêu chuẩn”.
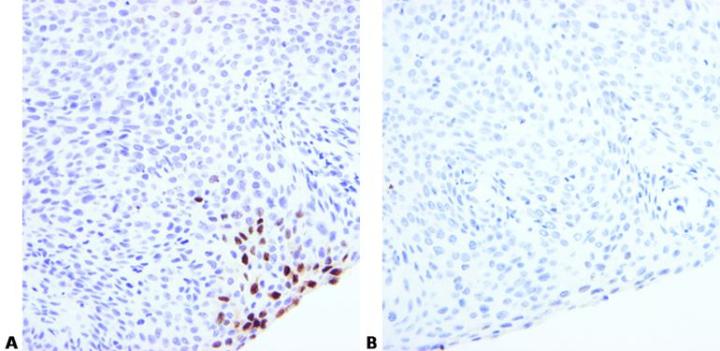
7. Tối ưu hóa điều kiện tiền xử lý
Chọn điều kiện tiền xử lý và tối ưu thích hợp. Những điều này sẽ phụ thuộc vào sự cố định và loại mô.
Việc sử dụng các điều kiện tiền xử lý enzyme giống nhau cho các mẫu dò khác nhau đôi khi có thể tạo ra kết quả kém.
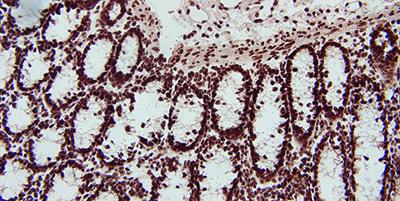
8. Xử lý mô cẩn thận
Xử lý cẩn thận các mẫu mô và cố định nhanh chóng sẽ hạn chế sự thất thoát RNA do hoạt động của các RNase nội sinh.
Việc xử lý bất cẩn các mẫu mô và quá trình cố định chậm gây ra sự mất mát RNA do hoạt động của các RNase nội sinh.
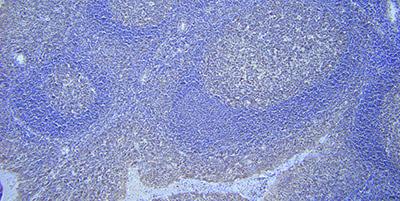
9. Sử dụng hệ thống phát hiện phù hợp
Chọn một hệ thống phát hiện và hiển thị tối ưu các điều kiện nuôi cấy
Việc thiếu độ nhạy trong hệ thống phát hiện và hiển thị có thể dẫn đến hiện tượng nhuộm màu rất ít hoặc thậm chí âm tính mặc dù đầu dò được liên kết với mục tiêu.
10. Tránh hoá chất bay hơi
Ngăn chặn sự bay hơi của dung dịch mẫu dò và các thuốc thử khác trong quá trình nuôi cấy. Do cần thời gian lâu nên việc làm khô hoá chất là một vấn đề phổ biến. Việc sử dụng các thiết bị chất lượng tốt là điều cần thiết.
Nếu đầu dò hoặc thuốc thử khác bị khô trên phần (thường là ở các cạnh), dẫn đến các vết bẩn, không đặc hiệu ở các khu vực.
11. Chuẩn hóa các bước làm sạch
Sử dụng các bước làm sạch tiêu chuẩn (thời lượng, khối lượng và hình thức khuấy trộn). Điều này sẽ đảm bảo tính nhất quán của kết quả.
Kết quả có thể thay đổi trong các lần chạy với cùng một đầu dò và giữa các lần chạy vào các ngày khác nhau. Điều này có thể là do các kỹ thuật làm sạch khác nhau.
13. Sử dụng các biện pháp kiểm soát phù hợp
Sử dụng các điều khiển thích hợp với mỗi lần chạy. Điều này nên bao gồm mô dương tính đã biết và đối chứng âm tính bằng cách sử dụng đầu dò không đặc hiệu.
“Chỉ kiểm soát khi phương pháp không hiệu quả”
14. Đánh giá kết quả chính xác
Bất kỳ ai thực hiện ISH đều phải có kiến thức cơ bản về lý thuyết cơ bản của kỹ thuật ISH để đánh giá và kiểm soát các phần cắt sau khi nhuộm
Nếu quan sát thấy bất kỳ vết nhuộm nào trong các phần thử nghiệm, thì giả định rằng vết nhuộm đạt yêu cầu.
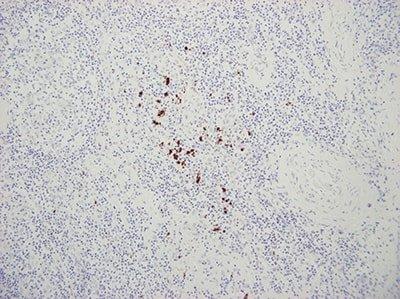
Nguồn: https://www.leicabiosystems.com/knowledge-pathway/steps-to-better-ish/
Minh Khang là nhà nhập khẩu và phân phối trực tiếp các sản phẩm hãng Leica Biosystems.


 EN
EN