Phương pháp đếm tế bào dòng chảy để phân loại hạt nano là một trong một số kỹ thuật được sử dụng để mô tả đặc tính của các hạt siêu nhỏ. Các hạt sinh học thường được khám phá trong phạm vi kích thước này bao gồm vi khuẩn, vi rút, túi ngoại bào và exosome. Công cụ phân tích này đã trở nên phổ biến hơn nhờ khả năng thông lượng cao và đa thông số. Trước đây người ta đã chứng minh rằng Máy đếm tế bào dòng chảy CytoFLEX của Beckman Coulter có khả năng phát hiện các hạt nano polystyrene 80 nm bằng cách sử dụng tham số Violet Side Scatter. Do các thành phần thiết kế quang học, ghép kênh phân chia bước sóng, điốt tuyết lở và laser diode, CytoFLEX đã được chứng minh là có mức độ tán xạ ánh sáng và độ nhạy huỳnh quang được nâng cao.Với những tiến bộ kỹ thuật quang học và sự gia tăng sử dụng phương pháp tế bào học dòng chảy để phân tích EV, đã có những nỗ lực nhằm chuẩn hóa các phương pháp tế bào học dòng chảy có kích thước nano. Sự chặt chẽ trong việc áp dụng sức mạnh của đặc tính hạt đơn, thông lượng cao, góp phần đáng kể vào những tiến bộ trong miễn dịch tế bào, sau đó có thể được áp dụng cho nghiên cứu EV.Mặc dù những nỗ lực này đã đạt được tiến bộ trong phân tích tế bào học dòng chảy ở quy mô nano, nhưng việc phân loại hạt nano vẫn là một kỹ thuật phức tạp không được sử dụng phổ biến. Trước đây, người ta đã chứng minh trên MoFlo Astrios rằng các túi có kích thước nano có thể được sắp xếp với hiệu suất từ 25 đến 45%. Tuy nhiên, thiết kế MoFlo Astrios là một định dạng lớn với các yêu cầu khối lượng công việc phức tạp để thiết lập và chạy loại có kích thước nano.Do thiết kế bổ sung của máy phân loại tế bào CytoFLEX SRT và máy phân tích tế bào CytoFLEX S (cả hai đều sử dụng máy dò APD, WDM và phát hiện VSSC 1), các đặc tính hiệu suất dự kiến sẽ tương tự nhau. Vì vậy, người ta nghĩ rằng việc phân loại hạt nano là khả thi. Ngoài ra, thiết lập sắp xếp tự động và thiết lập công cụ tối thiểu cần thiết để thực hiện phương pháp tế bào học dòng chảy ở quy mô nano có thể cho phép sử dụng máy phân loại tế bào CytoFLEX SRT làm công cụ cho các thí nghiệm được tiêu chuẩn hóa và tái sản xuất.
Trong các thí nghiệm sau đây, Beckman Coulter mô tả khả năng của máy phân loại tế bào CytoFLEX SRT để phân loại các mẫu có kích thước nano. Kết quả cho thấy hiệu quả cao hơn trong việc phân loại hạt nano so với các báo cáo hiện có và máy phân loại tế bào CytoFLEX SRT có thể phân loại được một số loại hạt nano.
Vật liệu & Phương pháp
Cài đặt thiết bị
Khởi động và QC hàng ngày được thực hiện theo hướng dẫn trong Hướng dẫn sử dụng máy phân loại tế bào CytoFLEX SRT. Tóm lại, sau khi bật thiết bị, chương trình khởi động hệ thống sẽ được chạy và đầu phun được lắp vào. Sau khi khởi động xong, cầu huỳnh quang CytoFLEX Daily QC được đặt lên trạm mẫu và thiết bị được hướng dẫn chạy QC. Sau khi vượt qua QC, thiết bị được cấu hình để phát hiện Phân tán bên (SSC) bằng cách sử dụng tia laser Violet. Do các bộ phận quang học của máy đo tế bào dòng chảy CytoFLEX S và máy phân loại tế bào CytoFLEX SRT không cần trả phí nên quy trình này có giá trị trên cả hai thiết bị. Điều này được thực hiện dễ dàng như hoán đổi vị trí WDM của bộ lọc 405/10 và bộ lọc 450, do đó loại bỏ kênh Pacific Blue và tạo kênh Violet Side Scatter (VSSC). Việc hoán đổi lại các bộ lọc sẽ cho phép đảo ngược cấu hình ban đầu.
Chuẩn bị hạt NIST, hạt huỳnh quang, VLP, vi khuẩn
Tất cả các hạt NIST (Polysciences, Inc., Warrington, PA) đã được chuẩn bị như mô tả trong FCMPASS – Thu thập và chọn lọc vật liệu tham chiếu tán xạ ánh sáng V.2. Tóm lại, mỗi chai gốc được trộn và sau đó pha loãng đến nồng độ 1×107 trong 500 µmL DPBS. Sau đó, các hạt được thu thập tổng cộng 10.000 sự kiện trong cổng được chỉ định bằng cách sử dụng cấu hình VSSC trên máy phân loại tế bào CytoFLEX SRT.
VLP được gắn thẻ eGFP và tdTomato đã được chuẩn bị và cung cấp bởi Tiến sĩ Rahm Gummuluru. Tóm lại, biểu hiện plasmit HIV-1 pGag-eGFP và/hoặc pGag-tdTomato biểu hiện protein huỳnh quang màu xanh lá cây được tăng cường Gag (eGFP) và/hoặc protein tổng hợp protein huỳnh quang tdTomato, đã được mô tả trước đây (Cat # ARP-11468 NIH Chương trình Thuốc thử HIV, Phòng AIDS, NIAID, NIH, do Marilyn D. Resh và George Pavlakis đóng góp). HIV Gag-eGFP/tdTomato, các hạt giống vi-rút (VLP) được tạo ra thông qua quá trình chuyển hóa qua trung gian canxi photphat của các tế bào HEK293T. Sau khi thu hoạch, chất nổi phía trên chứa VLP được làm sạch khỏi các mảnh vụn tế bào, đi qua bộ lọc 0,45-µm M và được tạo thành viên qua đệm sucrose 20%. Nội dung Gag p24 của VLP được xác định bằng ELISA.
Các chủng Bacillus subtilis được tạo ra bằng cách biến nạp thành B. subtilis 168 trpC2 (PB2) và các dẫn xuất của nó trừ khi có ghi chú khác. Các chủng B. subtilis được biến nạp với 5–10 µmL DNA plasmid hoặc 1–2 µL DNA bộ gen bằng phương pháp hai bước. DNA bộ gen được điều chế bằng cách sử dụng Bộ lọc DNA bộ gen Wizard (Promega) theo hướng dẫn của nhà sản xuất. Các nền văn hóa được trồng ở LB (Lennox).
Phân tích sau sắp xếp
Tất cả hình ảnh được chụp bằng kính hiển vi Olympus BX62 (Tập đoàn Olympus, Tokyo, Nhật Bản). Hình ảnh được chụp bằng máy ảnh Andor Sona ở vật kính 40,0x với dầu ngâm. Cả kênh đơn FITC và kênh đơn Texas Red đều được sử dụng với độ phơi sáng được đặt thành 100 ms.
Kết quả
Trong phần này sẽ mô tả cách sắp xếp các thực thể khác nhau có kích thước khác nhau, với kích thước giảm dần và độ phức tạp tăng dần. Các phương pháp chi tiết được mô tả trong phần trước. Sự đa dạng của các thí nghiệm sắp xếp được mô tả ở đây nhằm mục đích chứng minh tính linh hoạt của máy phân loại tế bào CytoFLEX SRT.
Phân loại vi khuẩn đơn (>250µm)
Một mẫu Bacillus subtilis được kích hoạt có nhãn YFP được phân tích bằng kênh FITC (525/40). Vi khuẩn dương tính được kiểm soát và sau đó một vi khuẩn duy nhất được sắp xếp trên một phiến kính và được xác minh bằng kính hiển vi huỳnh quang. Thử nghiệm được thực hiện để xác minh khả năng của máy trong việc phân loại sinh vật tương đối nhỏ (dài 2-6 µm và đường kính 0,25–1,0 µm) có chỉ số khúc xạ tương tự như EV là 1,38 4.
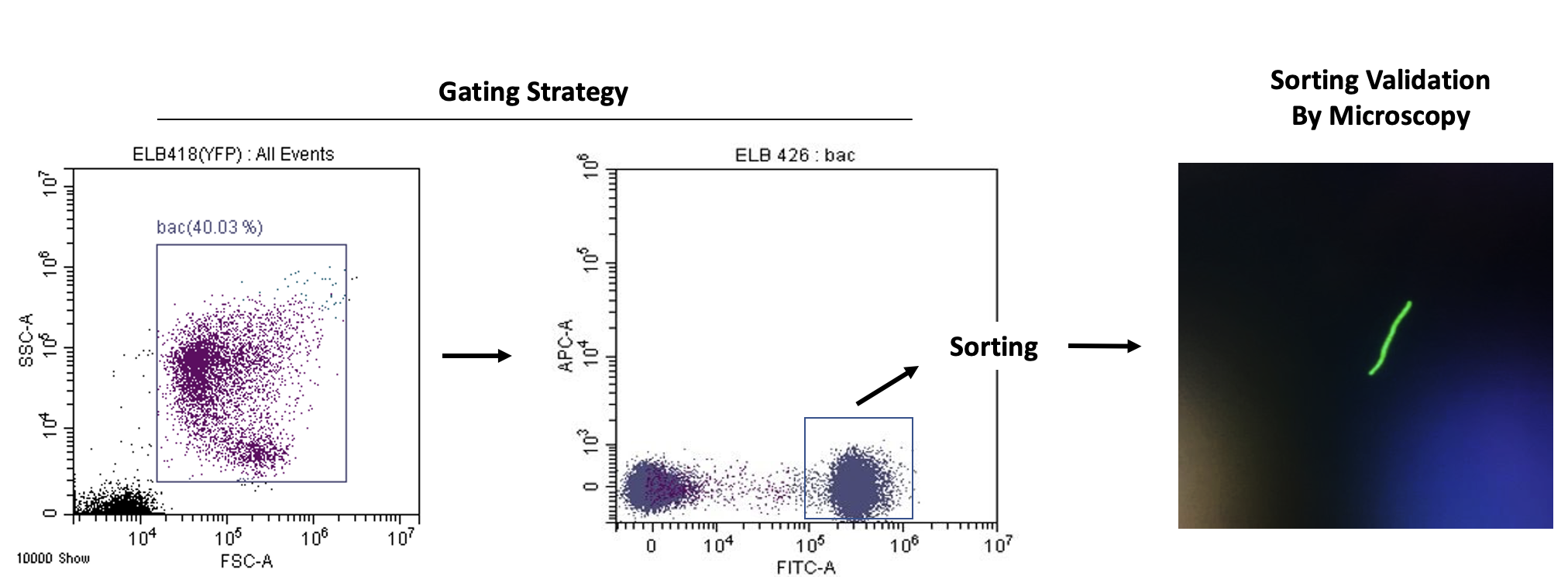
Vi khuẩn nuôi cấy được sắp xếp theo các vùng phân loại để loại bỏ mảnh vụn và vi khuẩn kép, và cuối cùng là vi khuẩn dương tính với YFP (Ngưỡng VSSC 1650/Gain 300, FITC-750, SSC-100). Sau khi lắng đọng trên phiến kính và hiển thị bằng kính hiển vi Olympus BX62. Hình ảnh được chụp bằng máy ảnh Andor Sona ở vật kính 40x với dầu ngâm.
Phân loại hạt nano YG 100nm
Tiếp theo, các hạt YG Polystyrene 100 nm được trộn với các hạt không huỳnh quang 150 nm. Các hạt 100nm được sắp xếp năm hạt trên một tiêu bản và một hạt duy nhất trên một tiêu bản. Ngưỡng được đặt đủ thấp (Ngưỡng VSSC 3000/Tăng 300, FITC-400, SSC-500) để trực quan hóa hai quần thể hạt và loại bỏ các sự kiện nhiễu điện tử và chất lỏng. Loại thử nghiệm này được thực hiện để xác định xem thiết bị có khả năng phân loại các hạt nano bằng tiêu chuẩn phi sinh học hay không.
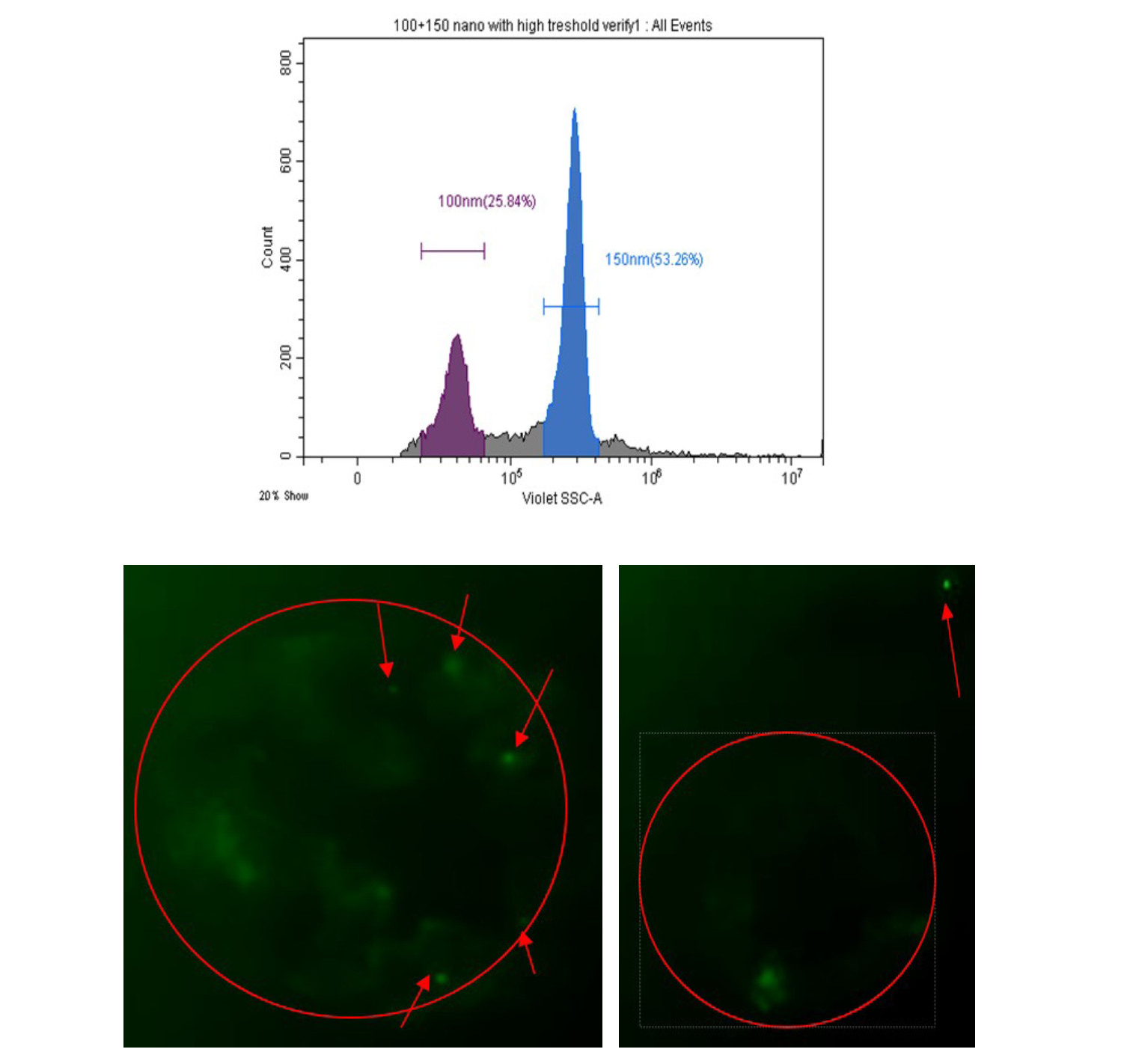
Các hạt 100 nm được phân tách bằng vùng 100 nm trên tham số VSSC (trên cùng). Sau khi lắng đọng trên một lam kính, các hạt được chụp ảnh ở độ phóng đại 40 lần (phía dưới) . Việc sắp xếp cho cả 5 hạt mỗi vị trí (trái) và 1 hạt mỗi vị trí (phải) đã được thực hiện. Mũi tên trên mỗi hình ảnh chỉ vị trí của hạt 100nm. Lưu ý mức nền cao do các tinh thể muối hình thành khi vỏ khô.
Phân loại eGFP và tdTomato có nhãn VLP
Các hạt VLP được dán nhãn eGFP và tdTomato (100-120 nm, RI 1.369 5 ) đóng vai trò là các biện pháp kiểm soát sinh học tiếp theo. Đây là những hạt nano có đặc tính tốt với tín hiệu sáng. Các mẫu được phân tích trên bộ kích hoạt VSSC trước khi chuyển sang bộ kích hoạt huỳnh quang tương ứng tối ưu cho từng loại protein huỳnh quang. Ngưỡng VSSC ban đầu được đặt bằng cách sử dụng các hạt NIST như được mô tả trong giao thức FCM PASS. Tối thiểu 100.000 sự kiện đã được thu thập. Sau đó, các ống thu thập được cô đặc bằng bộ lọc Amicon và phân tích lại trên thiết bị. Kết quả được thể hiện trong hình 3 và 4.

Ống thu thập dương tính <strong.(bottom> hiển thị >96% các sự kiện trong cổng dương tính được xác định trước đó(bảng giữa trên cùng). Ống thu âm (bảng dưới cùng bên trái) hiển thị l <1% ở cổng dương. </strong.(bottom>
Vì mục tiêu của các thí nghiệm này là ghép các tín hiệu phân tử cho các miRNA khác nhau nên các mẫu eGFP và tdTomato VLP đã được kết hợp để kiểm tra xem liệu các quần thể huỳnh quang khác nhau có thể được phân tách trên SRT với độ tinh khiết cao hay không. Sau khi phân loại thành các ống thu thập cổng dương tính FITC và PE được phân tích để kiểm tra độ tinh khiết. Quần thể dương tính với tdTomato cho thấy độ tinh khiết 97% và quần thể dương tính với GFP cho thấy độ tinh khiết 98%. Kết quả được thể hiện trong hình 4.
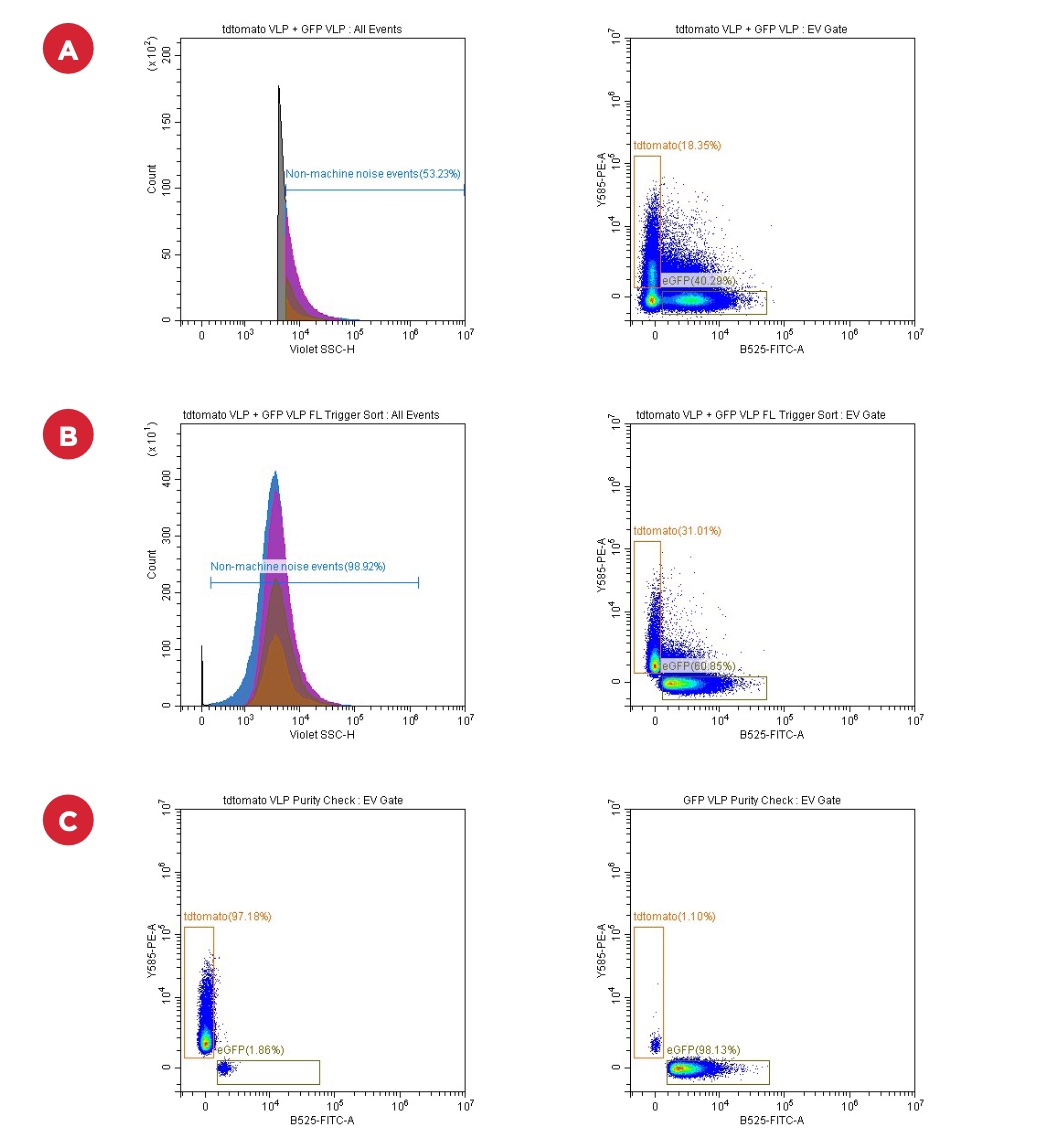
(A) Mức tăng và ngưỡng: VSSC 200, SSC 400, GFP 700, tdTomato 500. Ngưỡng VSSC 4000. (B) Mức tăng và ngưỡng: VSSC 200, SSC 400, GFP 700, tdTomato 500. Ngưỡng GFPH 1000 và tdTomato 1000. ( C) Sự phục hồi của các quần thể được sắp xếp dựa trên B. Tiếng ồn máy được xác định bằng cách chỉ chạy bộ đệm mẫu để cho phép điều chỉnh ngưỡng nhằm loại bỏ phần lớn tiếng ồn.
Phần kết luận
Một số kỹ thuật được sử dụng để phân tích và mô tả đặc tính của sinh học có kích thước nano. Khi việc sử dụng phương pháp đếm tế bào dòng chảy trong lĩnh vực nghiên cứu kích thước nano ngày càng tăng và nhu cầu phân lập các hạt cụ thể ngày càng cấp thiết, chúng tôi đã thử nghiệm khả năng thực hiện phân loại EV. Trong ghi chú ứng dụng này, chúng tôi sẽ báo cáo phân tích và phân loại hạt nano khác nhau bằng cách sử dụng máy phân loại tế bào CytoFLEX SRT. Tổng hợp dữ liệu được trình bày ở đây cho thấy rõ ràng rằng máy phân loại tế bào CytoFLEX SRT có khả năng phân loại các hạt có đường kính dưới 1 micron. Các thí nghiệm nhằm mục đích phân loại vi khuẩn, hạt giống virus và hạt đã tạo ra kết quả có chất lượng cao. Beckman Coulter có thể chứng minh sự phân loại có độ tinh khiết cao của các hạt có kích thước nano trong một thiết bị có độ phức tạp thấp hơn đáng kể so với các giải pháp dựa trên phương pháp đếm tế bào dòng chảy khác.
Nguồn: https://www.mybeckman.vn/resources/reading-material/application-notes/nanoscale-sorting-cytoflex-srt
Minh Khang là nhà phân phối và nhập khẩu trực tiếp các loại máy đếm tế bào dòng chảy hãng Beckman Coulter.



 EN
EN