Insulin là một loại thuốc có đặc tính tốt được sử dụng để điều trị bệnh tiểu đường. Một số lượng lớn công thức insulin đã được nghiên cứu để phát triển thời gian cung cấp insulin tối ưu phù hợp với nhu cầu của bệnh nhân. Ngoài ra, một số chất tương tự insulin như Insulin Glargine và LysPro insulin (Humalog) đã được phát triển dưới dạng dẫn xuất để sử dụng ngay trong bữa ăn và giải phóng kéo dài. Với việc ban hành một số hướng dẫn về thuốc sinh học tương tự, một số công ty dược phẩm sinh học đang tích cực theo đuổi các phiên bản của các sản phẩm được bán trên thị trường này để giải quyết nhu cầu của bệnh nhân. Sinh khả dụng của tất cả các sản phẩm này phụ thuộc rất nhiều vào không chỉ cấu trúc chính của chất tương tự mà còn cả công thức. Siêu ly tâm phân tích (AUC) được nghiên cứu như một công cụ tiềm năng để phân tích cấu trúc bậc cao của insulin trong các điều kiện công thức điển hình. AUC được sử dụng để thăm dò ảnh hưởng của nồng độ insulin, bổ sung kẽm và chất tạo phức kẽm EDTA lên sự hình thành monome, dimer và hexamer theo Tiêu chuẩn USP. Hexamer kẽm cho thấy sự phụ thuộc vào nồng độ EDTA với việc tăng các loại dimer và monome ở nồng độ EDTA cao hơn. Các phương pháp này nêu bật việc sử dụng Beckman Coulter ProteomeLab XL-I để xác định đặc tính của dược phẩm sinh học trong các điều kiện khác nhau để phát triển công thức.
Kỹ thuật phân tích Insulin bằng phương pháp siêu ly tâm phân tích
Năm 2012, 29,1 triệu người Mỹ, hay 9,4% dân số, mắc bệnh Tiểu đường Loại 1 hoặc Loại 2 theo Hiệp hội Tiểu đường Hoa Kỳ và là nguyên nhân gây tử vong đứng thứ 7 tại Hoa Kỳ vào năm 2010 với 69.071 ca tử vong. Phương pháp điều trị chính cho bệnh tiểu đường Loại 1 là điều trị bằng insulin hàng ngày vì những bệnh nhân này không có khả năng tự sản xuất đủ insulin. Thông thường, bệnh nhân tiểu đường loại I cần tiêm insulin nhiều lần mỗi ngày vào bữa ăn. Tuy nhiên, ngay cả khi được tiêm đúng cách, việc tiêm insulin cũng không tái tạo được đặc tính tác dụng theo thời gian tự nhiên của insulin, và do đó các chất tương tự đã được phát triển và hiện đang được phát triển để nâng cao hiệu quả. Phần lớn nghiên cứu hiện tại về đặc tính tác dụng của insulin dựa vào phép cân bằng hóa học của phân tử trong điều kiện bào chế và điều kiện pha loãng sau khi tiêm vào cơ thể người.
Nhiều phương pháp được các công ty dược phẩm sinh học thường xuyên sử dụng để đo kích thước hạt và tính không đồng nhất ở trạng thái dung dịch. AUC hoạt động bằng cách xác định kích thước hạt, tính không đồng nhất và tỷ lệ ma sát thông qua thao tác phương trình Lamm mô tả các hạt khi chúng lắng đọng qua chất lỏng dưới tác dụng của lực. AUC trước đây đã được báo cáo là đo lường tác động của công thức lên hệ số lắng của insulin nhưng chưa bao giờ đánh giá theo tác động của kẽm và phức chất lên cấu trúc bậc cao.
Nguyên vật liệu
Dibasic natri photphat, kẽm clorua, EDTA và glycerol được mua từ Fisher Scientific. Natri hydroxit được mua từ Fluka và axit clohydric được mua từ BDH Chemicals. Tiêu chuẩn USP được mua từ Fisher Scientific.
ProteomeLab XL I, tế bào phân tích vận tốc lắng đọng hai khu vực, quartz windows, rôto 60 Ti, rôto 50 Ti và giá đỡ mô-men xoắn đều được mua từ Beckman Coulter, Inc..
Phương pháp
Chuẩn độ nồng độ Insulin không có công thức: Insulin được hòa lại thành 50 mg/mL trong HCl 0,04 N và pha loãng đến nồng độ tương ứng. Dung dịch đệm tham chiếu phù hợp với dung môi mẫu, không có Insulin, cũng được tạo ra. 420 µl cả mẫu đối chứng và mẫu được nạp vào ô phân tích 2 khu vực, căn chỉnh với rôto An 60 Ti và được cân bằng ở 20˚C trong hơn 1 giờ. Các mẫu sau đó được quay ở tốc độ 60.000 vòng/phút, 20˚C, quét 4 giờ ở bước sóng Abs 280nm ở chế độ liên tục.
Chuẩn độ nồng độ Insulin theo công thức: Insulin được hòa lại thành 50 mg/mL trong HCl 0,04 N và pha loãng đến nồng độ tương ứng và được pha chế với 150 μM ZnCl 2 , 16 mg/mL glycerol, 1,9 mg/mL natri photphat dibasic và 2,2 mM NaOH. Dung dịch đệm tham chiếu phù hợp với dung môi mẫu, không có Insulin, cũng được tạo ra. 420 µl cả mẫu đối chứng và mẫu được nạp vào ô phân tích 2 khu vực, căn chỉnh với rôto An 60 Ti và được cân bằng ở 20˚C trong hơn 1 giờ. Các mẫu sau đó được quay ở tốc độ 60.000 vòng/phút, 20˚C, quét 4 giờ ở bước sóng Abs 280nm ở chế độ liên tục.
Chuẩn độ nồng độ kẽm: Insulin được hòa lại thành 50 mg/mL trong HCl 0,04 N và pha loãng thành 4 mg/mL được pha chế với các nồng độ khác nhau của ZnCl2, 16 mg/mL glycerol, 1,9 mg/mL natri photphat dibasic và 2,2 mM NaOH. Dung dịch đệm tham chiếu phù hợp với dung môi mẫu, không có Insulin, cũng được tạo ra. 420 µl cả mẫu đối chứng và mẫu được nạp vào ô phân tích 2 khu vực, căn chỉnh với rôto An 60 Ti và được cân bằng ở 20˚C trong hơn 1 giờ. Các mẫu sau đó được quay ở tốc độ 60.000 vòng/phút, 20˚C, quét 4 giờ ở bước sóng Abs 280nm ở chế độ liên tục. Rôto được dừng lại nhưng để trong điều kiện chân không ở nhiệt độ 20˚C. 15 ngày sau, tế bào được lấy ra khỏi rôto, lắc mạnh và chạy lại trong cùng điều kiện.
Chuẩn độ nồng độ EDTA: Insulin được tạo huyền phù lại thành 50 mg/mL trong HCl 0,04 N và pha loãng thành 2 mg/mL được pha chế với 150 μM ZnCl 2 , glycerol 16 mg/mL, natri photphat dibasic 1,9 mg/mL và NaOH 2,2 mM. Các nồng độ EDTA khác nhau được thêm vào sản phẩm được tạo thành và ủ trong 20 phút ở nhiệt độ phòng. Dung dịch đệm tham chiếu phù hợp với dung môi mẫu, không có Insulin, cũng được tạo ra. 420 µl cả mẫu đối chứng và mẫu được nạp vào ô phân tích 2 khu vực, căn chỉnh với rôto An 50 Ti và được cân bằng ở 20˚C trong hơn 1 giờ. Các mẫu sau đó được quay ở tốc độ 50.000 vòng/phút, 20˚C, quét 5 giờ ở bước sóng Abs 280nm ở chế độ liên tục.
Phân tích dữ liệu† : Dữ liệu được trích xuất từ bộ điều khiển AUC và nhập vào SEDFIT 14,7 g. Dữ liệu về độ hấp thụ được phân tích theo phân bố c(s) liên tục của các loài trầm tích sử dụng khoảng tin cậy chuẩn hóa entropy tối đa là 0,68. Trong mọi trường hợp, sự phù hợp tuyệt vời đã được quan sát thấy với độ lệch bình phương trung bình gốc nằm trong khoảng từ 0,0016 đến 0,0093 đơn vị độ hấp thụ. Thể tích cụ thể một phần của insulin được tính toán dựa trên thành phần axit amin trong SEDNTERP; mật độ ρ và độ nhớt η cho mỗi dung dịch đệm công thức cũng được tính toán trong SEDTERP. Một mô hình c(s) đã được sử dụng trong đó tỷ số ma sát f/fo được thả nổi và thể tích riêng được tinh chỉnh. Dữ liệu được trích xuất thành GUSSI và được vẽ cho c(s) với ràng buộc tối thiểu giá trị s ở 0,3S.
Kết quả và thảo luận
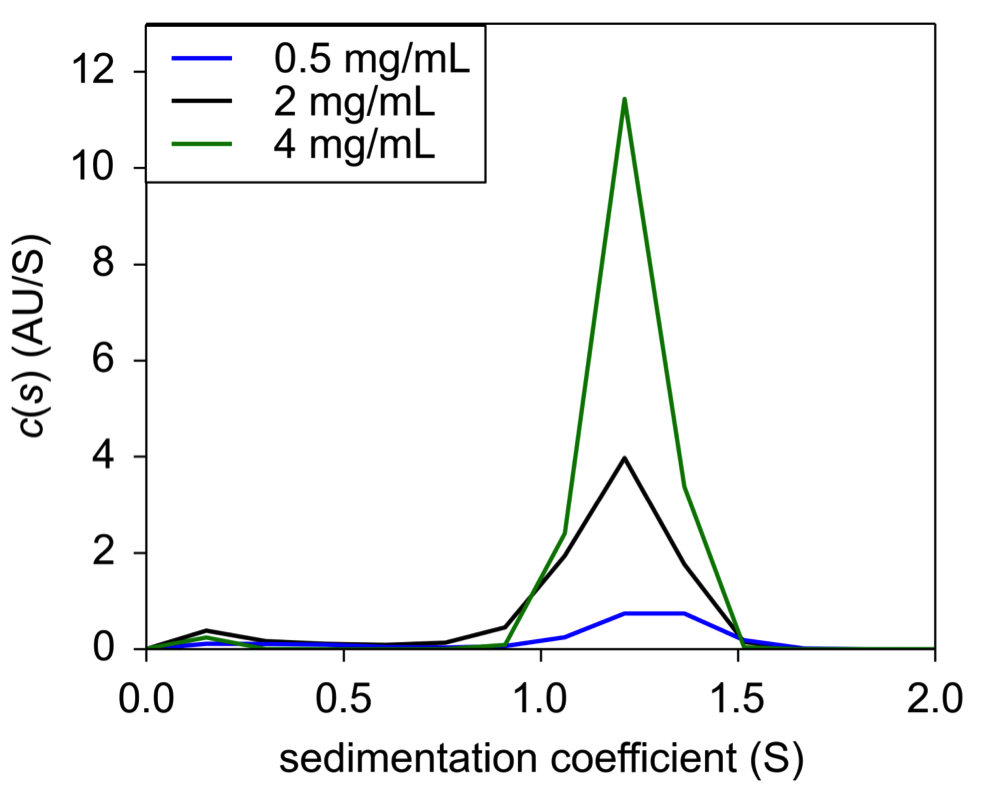
USP Human Insulin đã được pha loãng thành ba nồng độ khác nhau trong HCl 0,04 N và được nạp vào 2 tế bào AUC tốc độ lắng đọng 2 khu vực. Phân tích cho thấy rằng cả ba nồng độ đều tập trung vào phân tích 1,2 S thông qua c(s) bằng phần mềm phổ biến SEDFIT (Hình 1). Các giá trị c(s) không được chuẩn hóa để hiển thị sự thay đổi tín hiệu khi nồng độ giảm. Giá trị thu được là 1,2 S rất có thể là đại diện cho insulin đơn phân, phù hợp với Pohl, et.al. và nhất quán với đặc tính của monome.
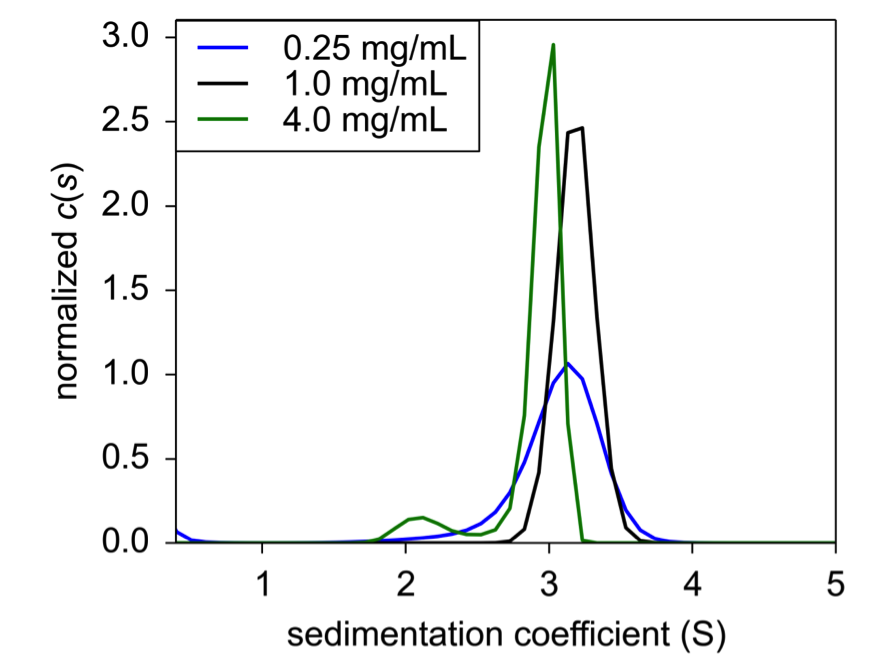
Trong điều kiện công thức điển hình, insulin lại được lắng đọng và phân tích hệ số lắng đọng. Ở đây, insulin có s20,w trong khoảng 2,95 – 3,1 S, nhưng ở mức 4,0 mg/mL, một loài nhỏ ở 2,12 S nổi lên với giá trị trọng lượng tín hiệu là 8,3% của vật liệu lắng đọng tổng thể (Hình 2). Đỉnh mới này rất có thể là đại diện của insulin dimeric. Điều thú vị là protein phân ly ở nồng độ cao nhất, cho thấy sự lắp ráp không phụ thuộc vào nồng độ; đúng hơn là sự phân ly có nhiều khả năng là do điều kiện không bão hòa của một trong các tá dược.
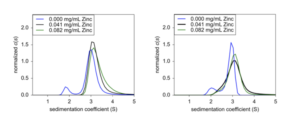
Để khám phá tác dụng, nồng độ kẽm trong dung dịch đệm công thức và tác động lên hệ số lắng đã được nghiên cứu. Ở nồng độ insulin cố định, việc bổ sung kẽm đã đẩy sự hình thành phức tạp về phía hexamer khoảng 3,0 S (Hình 3A). Do đó, kẽm rất quan trọng đối với công thức hexamer thích hợp và ở nồng độ insulin cao, lượng kẽm không còn ở mức bão hòa, dẫn đến số lượng loài nhỏ hơn rất có thể đại diện cho insulin dimer. Để xác định xem hiệu ứng có phụ thuộc vào thời gian hay không, các công thức tương tự được để trong các tế bào phân tích trong 15 ngày trong điều kiện chân không ở 20˚C và lắng đọng lần thứ hai. Kết quả giống nhau đối với cả hai lần quay, cho thấy insulin hexamer ổn định trong ít nhất 15 ngày sau khi lập công thức (Hình 3B).
Cuối cùng, để xác nhận vai trò của kẽm trong việc hình thành hexamer insulin, EDTA đã được chuẩn độ vào công thức để hoạt động như một chất chelat. Ở đây, cả nồng độ insulin và kẽm đều được cố định ở điều kiện ổn định hexamer, sau đó EDTA được thêm vào và ủ trong 20 phút. Khi tăng nồng độ EDTA, insulin hexameric được phân tách thành các loại monome và dimer (Hình 4). Ở 75 μM EDTA, khoảng 11% phức hợp hexameric đã phân ly thành monome (Bảng 1). Ở mức 150 μM, thêm 15% đã phân tách thành tín hiệu trọng lượng đơn phân tổng ở mức 26,4%. Ở mức 300 μM, các loài hexameric đã hòa tan hoàn toàn thành khoảng 60% monome và 40% dimer. Cuối cùng, ở mức 600 μM, insulin tồn tại ở mức khoảng 68% monome và 32% dimer.
Kết luận
Insulin là một loại thuốc có đặc tính tốt được sản xuất bởi nhiều nhà sản xuất khác nhau trên toàn thế giới và đã được sử dụng để điều trị bệnh tiểu đường trong hơn 80 năm. Ngày nay, các công ty dược phẩm sinh học đang thực hiện những nỗ lực lớn nhằm tạo ra các dẫn xuất insulin và công thức mới nhằm cải thiện hiệu quả, phương pháp sử dụng và hồ sơ hành động theo thời gian. Trong sự phát triển của các chất tương tự insulin trong tương lai, ảnh hưởng của các tá dược như kẽm sẽ cần được xem xét đến trạng thái lắp ráp của thuốc. Những hiệu ứng này có thể được thăm dò bằng một số kỹ thuật phân tích.
Mức độ tổng hợp insulin thường được kiểm soát bằng phương pháp SEC chuyên khảo Insulin ở người. Phương pháp này được sử dụng để đo các tập hợp cộng hóa trị của insulin chẳng hạn như các chất nhị trùng cộng hóa trị là kết quả của phản ứng ngưng tụ của các amin tự do ở đầu N và/hoặc ở các lysine tự do. Sự kết tụ cộng hóa trị có thể xảy ra thông qua sự phá vỡ và tái cấu trúc các liên kết disulfide. Tuy nhiên, phương pháp này không thể đo được mức độ tương đối của các tập hợp không cộng hóa trị như insulin hexamer với mức monome. Các tập hợp không cộng hóa trị này bị gián đoạn trong quá trình chuẩn bị và/hoặc phân tích mẫu SEC. AUC như được trình bày trong ghi chú ứng dụng này, được chứng minh là hữu ích trong việc đánh giá mức độ của các tập hợp không cộng hóa trị như insulin hexamer. Đây, chúng tôi đã chứng minh một cách tiếp cận đơn giản để mô tả cấu trúc bậc cao của một loại dược phẩm sinh học thông thường với sự phát triển tối thiểu. Hầu hết các phương pháp bậc cao hơn, chẳng hạn như SEC, yêu cầu pha trộn mẫu thông qua độ pha loãng lớn và/hoặc tương tác ma trận cột có thể làm thay đổi thêm trạng thái tổng hợp. Hơn nữa, mặc dù SEC hiện là phương pháp được ưa thích để đo các tập hợp cộng hóa trị, phạm vi khối lượng mol của AUC xấp xỉ từ vài trăm đến 10.9 dalton, một phạm vi vượt quá khả năng phân tích thông thường của SEC. Cuối cùng, AUC có thể tạo ra thông tin định lượng xung quanh các đặc tính của protein bao gồm trọng lượng phân tử, hình dạng, đặc tính hòa tan, các biến đổi sau dịch mã và các dao động về hình dạng ở nồng độ đạt tới 40-50 mg/mL, định vị công cụ này là một kỹ thuật độc lập hoặc trực giao đến phương pháp dược phẩm sinh học được sử dụng truyền thống của SEC để nghiên cứu tính tương tự sinh học, sự tổng hợp, khả năng so sánh giữa các lô và phát triển công thức.
Minh Khang là nhà phân phối và nhập khẩu trực tiếp các sản phẩm hãng Beckman Coulter.



 EN
EN