Quá trình khử canxi mô tả kỹ thuật loại bỏ khoáng chất khỏi xương hoặc các mô bị vôi hóa khác để có thể chuẩn bị các phần parafin chất lượng tốt nhằm bảo toàn các tính chất thiết yếu trong mô. Khử canxi được thực hiện sau khi mẫu mô đã được cố định hoàn toàn và trước khi xử lý thông thường thành parafin. Trong bài viết này, trình bày về cấu trúc cơ bản của xương và các phương án kỹ thuật để chuẩn bị các phần cắt đạt chuẩn, vai trò của quy trình khử canxi và nêu một số dung dịch khử canxi.
Giới thiệu
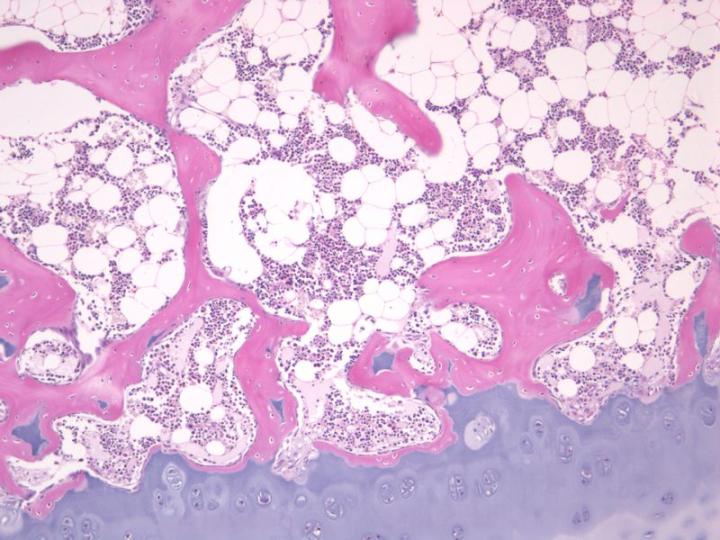
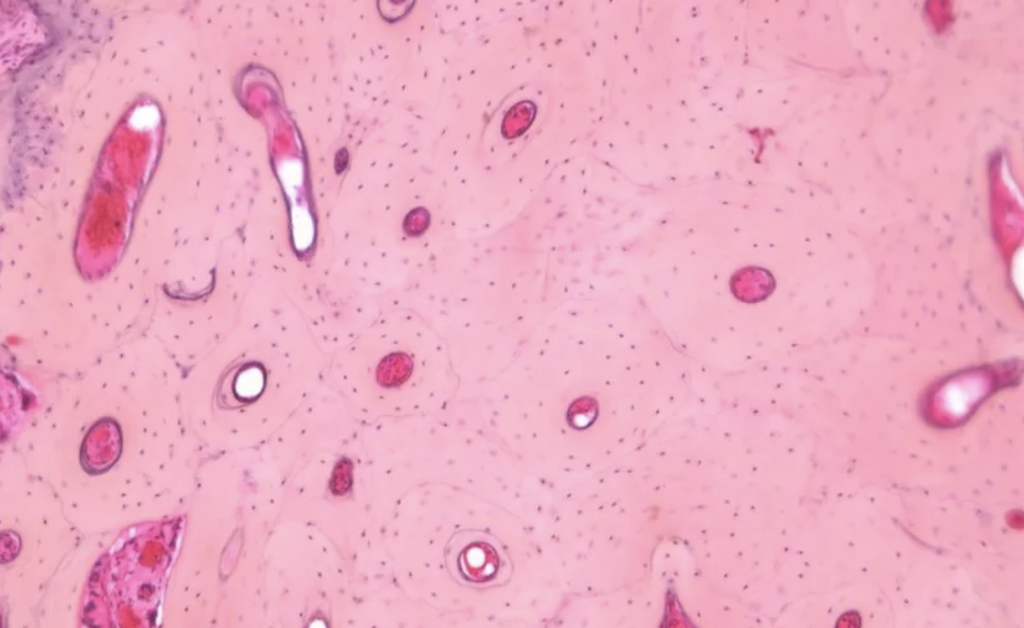
Các nhà nghiên cứu mô bệnh học có thể lựa chọn những phương pháp có sẵn để tạo ra các phần cắt từ xương hoặc các mẫu mô bị vôi hóa khác. Khi lựa chọn kỹ thuật xử lý mô, cần phải xem xét loại mô đang thực hiện. Ví dụ, nếu đang nghiên cứu về bệnh chuyển hóa xương và cần phân biệt xương khoáng hóa với xương dạng xương, hoặc nếu cần đo hình thái thì phải giữ lại và chứng minh hàm lượng khoáng chất bằng cách tạo ra các phần xương không bị canxi hóa. Vì xương khoáng hóa rất cứng nên có rất ít kỹ thuật để tạo ra các phần cắt từ nó. Sau khi cố định mô, xương có thể cắt trực tiếp thành những phần mỏng để xác định tình trạng vôi hóa xương (lắng đọng canxi) (Hình 1). Cũng có thể sử dụng nhựa acrylic hoặc nhựa epoxy để chuẩn bị các mẫu xương, khi được polyme hóa, chúng có độ cứng tương đương với xương kháng hóa. Sau đó, có thể tạo ra phần cắt xương bị vôi hóa từ các mẫu trên hoặc cắt trực tiếp bằng máy cắt vi phẫu công suất lớn của Leica Biosystems và dao cacbua vonfram và dao kim cương (Hình 2). Phần đông lạnh của xương xốp khoáng hóa là một phương pháp khác.
Thông thường, xương và các mẫu bị vôi hóa khác được khử canxi sau khi cố định và được xử lý bằng phương pháp tiêu chuẩn để tạo ra các phần parafin. Các phần khử canxi được sử dụng để kiểm tra tủy xương và chẩn đoán khối u, nhiễm trùng hoặc cho các mục đích khác. Các mẫu vật có thể ở dạng mào xương chậu, hoặc các mảnh xương được lấy ra khi phẫu thuật (chẳng hạn như chỏm xương đùi) hoặc được mổ xẻ từ các mẫu vật bị cắt cụt. Chụp X quang chi tiết tốt thường được sử dụng để hỗ trợ việc lựa chọn mẫu xương thích hợp để xử lý. Ngoài xương, các mô khác có thể bị vôi hóa liên quan đến quá trình thoái hóa như hoại tử (vôi hóa loạn dưỡng) hoặc có thể xảy ra ở thành mạch máu hoặc ở thận, phổi hoặc nơi khác (vôi hóa di căn). Nếu diện tích bị vôi hóa trong các mẫu mô quá lớn thì sẽ không có được các phần cắt tốt nếu không khử canxi mẫu trước tiên. Một khả năng khác là áp dụng “khử canxi bề mặt” cho khối parafin để cho phép thu được các phần mà không thể xác định được canxi trước khi mẫu được xử lý.
Quy trình khử canxi tương đối đơn giản và được thảo luận rộng rãi trong các tài liệu tiêu chuẩn về kỹ thuật mô học. Tuy nhiên, nếu muốn đạt được kết quả chất lượng cao thì cần nhấn lưu ý một số điểm.
Cấu trúc của xương
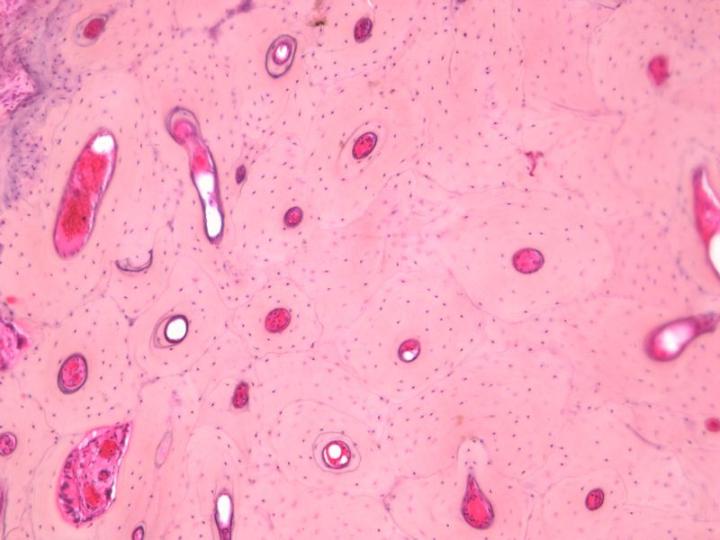
Xương bao gồm các tế bào (tế bào xương) được bao phủ bởi chất nền vôi hóa chứa các sợi collagen loại 1. Trong nền chất, canxi ở dạng tinh thể hydroxyapatite [Ca10(PO4) 6(OH)2] được lắng đọng giữa các phần tử dạng sợi. Những tinh thể này bị hòa tan trong quá trình khử canxi, nếu thực hiện đúng cách sẽ để lại mô gắn kết có đặc tính vật lý của mô liên kết sợi dày đặc.
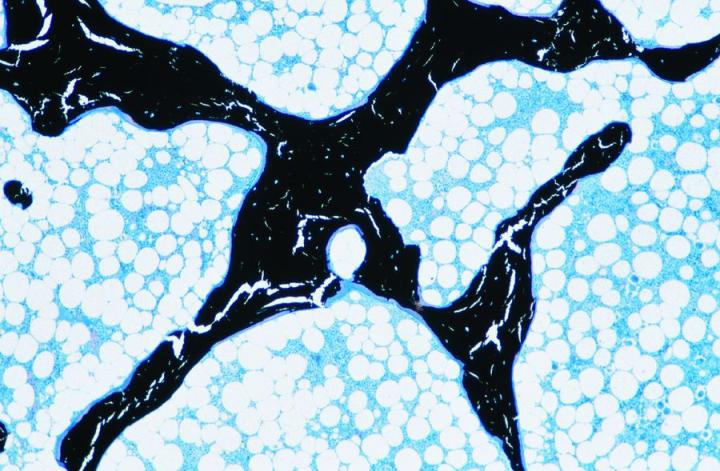
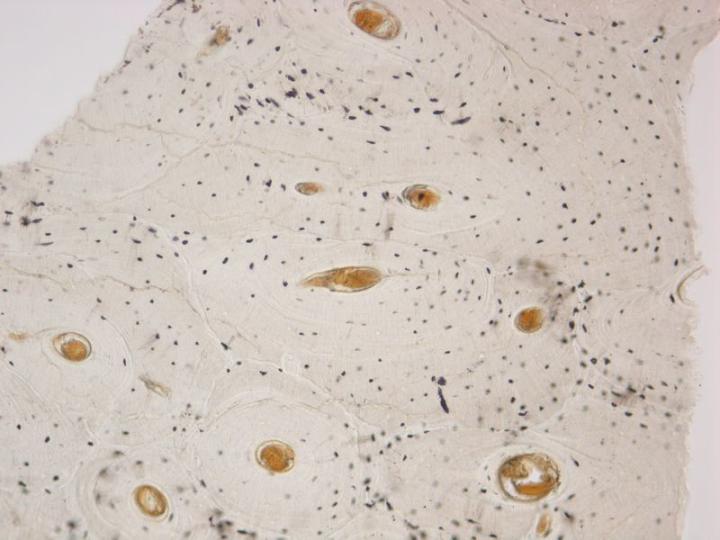
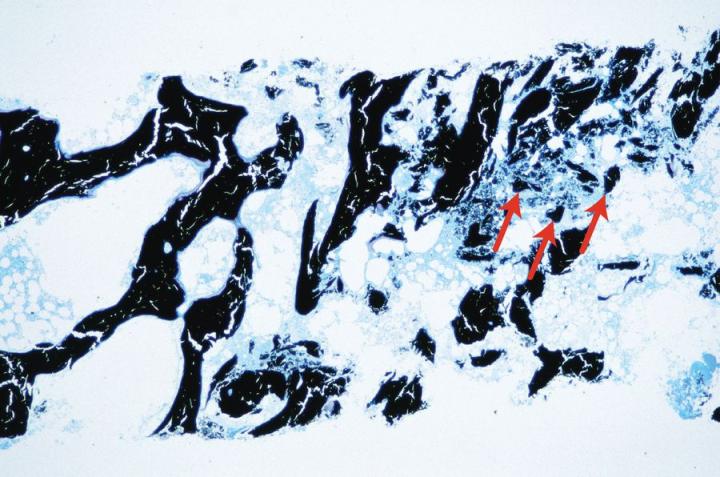
Có hai loại xương trưởng thành. Xương vỏ hoặc xương đặc tạo thành trục của xương dài và các phần chính của xương dẹt của hộp sọ và có cấu trúc rất đặc dựa trên sự sắp xếp của các cấu trúc hình trụ gọi là xương (Hình 3). Xương xốp bao gồm các vách ngăn mỏng (trabeculae) nối các tấm xương giữa đó có tủy xương. Nó nằm ở đốt sống và ở đầu xương dài (Hình 4). Cả xương đặc và xương xốp đều phát triển thành các lớp hoặc các phiến trong đó các sợi collagen được định cấu trúc và hiển thị hình ảnh đặc trưng dưới kính hiển vi ánh sáng phân cực (Hình 5).

Điều quan trọng là phải xem xét kỹ bản chất của bất kỳ mẫu xương nào vì lượng vỏ xương và xương xốp tương đối là quan trọng và sẽ xác định thời gian cần thiết cho quá trình khử canxi và xử lý. Ví dụ, mẫu mào xương chậu bao gồm một vành vỏ xương nằm trên một hình trụ bằng xương xốp. Vỏ xương sẽ là phần cuối cùng loại bỏ muối canxi trong quá trình khử canxi, và trừ khi nó được khử canxi hoàn toàn, sẽ rất khó để có được các phần chất lượng
Cố định xương
Để bảo vệ các thành phần tế bào và sợi của xương khỏi bị hư hại do axit được sử dụng làm chất khử canxi, điều đặc biệt quan trọng là phải cố định kỹ lưỡng các mẫu này trước khi khử canxi. Các mẫu cố định kém sẽ bị nhũn trong quá trình khử canxi và sau đó bị phai màu. Điều này rất dễ nhận thấy ở những vùng có chứa tủy xương. Do đó, các phòng thí nghiệm thường kéo dài thời gian cố định mẫu xương trước khi bắt đầu quá trình khử keo. Điều quan trọng là phải chuẩn bị sẵn sàng để chất cố định có thể làm mềm xương. Mẫu xương phải được cắt thành lát mỏng càng sớm càng tốt để tăng cường khả năng cố định và cung cấp đủ lượng chất cố định. Nên sử dụng máy cắt vi phẫu chất lượng cao để chuẩn bị các lát xương vì máy cắt thô có thể gây ra tổn thương cơ học và ép các mảnh xương vào các mô mềm của mẫu vật (Hình 6).
Dung dich Formol đệm là chất cố định thích hợp cho xương, nhưng trong trường hợp việc bảo quản tủy xương là quan trọng, một số phòng thí nghiệm sẽ sử dụng các chất thay thế như một trong các hỗn hợp Zinc formalin, B5, rượu axetic formol (chất cố định của Davidson) hoặc Bouin.
Các dung dịch khử canxi
Có 3 nhóm chính:
- Những dung dịch dựa trên axit khoáng mạnh
- Những dung dịch dựa trên axit hữu cơ yếu hơn
- Những dung dịch bao gồm các khoáng chất chelat .
Để thuận tiện, hầu hết các phòng thí nghiệm đều chọn từ nhiều loại thuốc thử độc quyền có sẵn. Người dùng cũng nên tham khảo MSDS liên quan để xác định thành phần hoạt tính có trong đó nếu thành phần đó không được nêu rõ ràng trong thông tin kỹ thuật được cung cấp.
Axit mạnh
Các axit mạnh như axit clohydric hoặc axit nitric ở nồng độ lên tới 10% có tác dụng nhanh nhất, nhưng nếu sử dụng quá lâu sẽ nhanh chóng gây mất màu và có thể làm hỏng mô. Nói chung, các chất khử canxi có tác dụng nhanh đều dựa trên axit mạnh, phổ biến nhất là axit clohydric và nên lưu ý hướng dẫn sử dụng nếu muốn thu được kết quả tốt. Ví dụ, Decalcifier II® của Surgipath có tác dụng nhanh và chứa axit clohydric. Hình 7 cho thấy hậu quả của việc xử lý kéo dài bằng chất khử canxi axit khoáng và không thử nghiệm điểm cuối của quá trình khử ion thích hợp.
Bảng 1: Chất khử canxi – axit khoáng
| Dung dịch khử cặn canxi | Công thức | Chú thích |
| Axit nitric | 5% trong nước cất | Tác dụng nhanh, vượt quá điểm cuối sẽ làm giảm khả năng nhuộm màu. |
| Perenyi’s fluid (1882) | Axit nitric 10% 40ml
Axit cromic 0,5% 30ml Cồn tuyệt đối 30ml |
Một chất khử canxi truyền thống, khử canxi chậm hơn axit nitric dạng nước. Hoạt động khá nhanh, vượt quá điểm cuối sẽ làm giảm khả năng nhuộm màu. |
| Axit clohydric | 5-10% trong nước cất | Formalin phải loại bỏ khỏi mẫu trước khi cho vào HCl để tránh hình thành bis-chloromethyl ether (chất gây ung thư). Tác dụng nhanh, vượt quá điểm cuối sẽ làm giảm khả năng nhuộm màu. |
| Von Ebner’s solution | Dung dịch bão hòa natri clorua. 50ml
Nước cất 42ml Axit clohydric 8ml |
Tác dụng nhanh, vượt quá điểm cuối sẽ làm giảm khả năng nhuộm màu. |
Axit yếu
Các axit yếu như axit formic được sử dụng phổ biến cho việc khử canxi. Axit formic có thể được sử dụng dưới dạng dung dịch nước 10% đơn giản hoặc kết hợp với formalin hoặc với chất đệm. Mặc dù chậm hơn so với các tác nhân axit mạnh nhưng nó tác động ít hơn và ít có khả năng cản trở quá trình nhuộm màu. Một ví dụ về chất khử canxi độc quyền dựa trên axit formic là Chất khử canxi I® của Surgipath. Các axit khác như axit trichloracetic (TCA) cũng đã được sử dụng. Axit picric, là thành phần của một số chất cố định, có đặc tính khử canxi yếu.
Bảng 2: Chất khử canxi – axit yếu
| Máy khử cặn | Công thức | Chú thích |
| Axit formic | 10% trong nước cất | Một chất khử canxi đơn giản hiệu quả. |
| Evans và Krajian | Axit formic 25ml
Natri citrat 10g Nước cất 75ml |
Một chất khử axit formic hiệu quả được đệm bằng citrate. |
| Kristensen | Axit formic 18ml
Natri formate 3,5g Nước cất 82ml |
Chất khử axit formic hiệu quả được đệm bằng formate |
| Gooding và Stewart | Axit formic 5-25ml
40% formaldehyd 5ml Nước cất 75ml |
Một chất khử canxi axit formic có thêm formalin, có tác dụng cố định và khử canxi. |
Chất chelat
Các khoáng chất chelat như axit ethylenediaminetetracetic (EDTA) hoạt động bằng cách thu giữ các ion canxi từ bề mặt tinh thể apatit, từ từ giảm kích thước của nó. Do quá trình này diễn ra rất chậm (có thể mất vài tuần tùy thuộc vào kích thước của mẫu), thuốc thử này không phù hợp với các mẫu khẩn cấp nhưng thích hợp hơn cho các ứng dụng nghiên cứu đòi hỏi hình thái chất lượng rất cao hoặc phải có các thành phần phân tử cụ thể được bảo quản cho các kỹ thuật như IHC, FISSH hoặc PCR. Nó được sử dụng ở nồng độ khoảng 14% dưới dạng dung dịch trung hòa. Tốc độ khử canxi của EDTA phụ thuộc vào độ pH. Nó thường được sử dụng ở pH 7,0. Nó hoạt động nhanh hơn ở pH10, nhưng một số thành phần mô có thể bị hư hỏng ở pH kiềm.
Bảng 3: Chất chelat
| Dung dịch khử cặn canxi | Công thức | Chú thích |
| EDTA trung tính | Muối dinatri EDTA 250g
Nước cất 1750ml Đưa đến độ pH 7,0 bằng cách thêm natri hydroxit (sẽ cần khoảng 25g). |
Tác dụng chậm nhưng ít gây tổn thương mô. Các vết nhuộm thường quy hầu như không bị ảnh hưởng. |
Các yếu tố ảnh hưởng đến tốc độ khử canxi
Nồng độ
Nồng độ của hoạt chất sẽ ảnh hưởng đến tốc độ loại bỏ canxi. Các công thức dành cho dung dịch khử canxi tạo ra sự cân bằng giữa tốc độ và mức độ tổn thương mô. Cần phải nhớ rằng nồng độ của hoạt chất sẽ bị cạn kiệt khi nó kết hợp với canxi và do đó, nên sử dụng một lượng lớn chất khử canxi và thay mới nhiều lần trong quá trình khử canxi
Nhiệt độ
Nhiệt độ tăng sẽ làm tăng tốc độ khử canxi nhưng cũng sẽ làm tăng tỷ lệ tổn thương mô vì vậy phải hết sức cẩn thận.
Khuấy trộn
Khuấy nhẹ có thể làm tăng tốc độ
Sự thâm nhập chất lỏng
Giống như việc cố định, chất khử canxi mới phải có khả năng tiếp cận dễ dàng với tất cả các bề mặt của mẫu vật. Điều này sẽ tăng cường sự khuếch tán và thâm nhập vào mẫu vật và tạo điều kiện thuận lợi cho dung dịch, ion hóa và loại bỏ canxi.
Các kỹ thuật khác để tăng hiệu quả khử canxi
Sonication được sử dụng với EDTA đã được sử dụng thành công để tăng tốc độ quá trình khử canxi của mẫu trephine để phân tích phân tử tiếp theo. Trong quá trình này, nhiệt độ phải được kiểm soát cẩn thận. Việc xử lý gia nhiệt đã được sử dụng với chất khử axit clohydric, nhưng nhiệt độ tăng lên có thể làm hỏng hình thái và gây ra hiện tượng ố màu. Nhựa trao đổi ion đã được tích hợp vào một số quy trình khử canxi. Chúng được thêm vào thùng chứa chất khử canxi và hấp thụ canxi bị ion hóa để duy trì hiệu quả của axit. Nếu chất khử axit được sử dụng với số lượng vừa đủ và được thay thế thường xuyên thì việc sử dụng các loại nhựa như vậy có lẽ là không cần thiết. Khử canxi bằng điện phân trong đó xương được đặt trong chất khử axit và gắn vào một điện cực có dòng điện chạy qua là một kỹ thuật chưa được phổ biến rộng rãi vì có khả năng gây tổn hại nhiệt cho mẫu vật.
Xác định điểm cuối của quá trình khử canxi
Để đạt được kết quả chất lượng cao, điều quan trọng là phải xác định thời điểm mà toàn bộ canxi đã được loại bỏ, bởi vì, từ thời điểm này tổn thương mô dường như xảy ra với tốc độ ngày càng tăng. Quá trình khử canxi quá mức, đặc biệt là với các chất khử axit mạnh, sẽ làm hỏng sự nhuộm màu của các thành phần ưa bazơ như nhân tế bào và trong một số trường hợp, có thể gây ra hiện tượng các thành phần mô mềm hơn. Mặt khác, các mẫu không được khử canxi hoàn toàn có thể khó hoặc không thể cắt được.
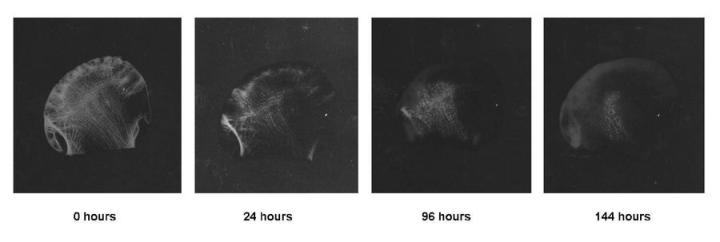
Phương pháp tốt nhất, đặc biệt với những mẫu vật lớn như đầu xương đùi, là chụp X-quang mẫu vật. Chụp X-quang chất lượng tốt sẽ phát hiện rõ ràng cặn canxi còn sót lại rất nhỏ và cho phép điều trị thêm nếu cần. Đây là một phương pháp tối ưu để theo dõi quá trình khử canxi của các mẫu vật lớn như đầu xương đùi (Hình 8). Một thử nghiệm hóa học đơn giản có thể được áp dụng khi sử dụng một số chất khử axit (đặc biệt là axit formic). Dung dịch amoni oxalat được thêm vào mẫu có sự thay đổi cuối cùng của chất khử canxi đã được trung hòa bằng amoni hydroxit. Nếu có canxi, kết tủa của canxi oxalate sẽ hình thành cho thấy quá trình khử canxi có thể chưa hoàn tất và cần phải có thời gian khử canxi lâu hơn. Các xét nghiệm vật lý yêu cầu thao tác: thăm dò mô để xác định các vùng bị vôi hóa còn lại, tuy nhiên chưa thực sự mang lại kết quả tốt nhất. Hư hỏng có thể xảy ra trong quá trình này và có thể dễ dàng bỏ qua những cặn canxi nhỏ. Phương pháp xác định điểm cuối bằng cách cân cẩn thận mẫu sau khi rửa với nước cũng đã được mô tả. Đây có thể là một phương pháp hiệu quả đối với các mẫu vật lớn.
Khi đến điểm cuối của quá trình khử canxi và bạn muốn làm chậm quá trình này để tránh khử canxi quá mức và làm tổn thương mô, rửa sạch và đặt lại vào formalin (nếu sử dụng axit clohydric). Quá trình khử canxi sau đó có thể được tiếp tục khi cần thiết. Một cách khác là làm lạnh mẫu ở 4˚C trong dung môi khử canxi để làm chậm quá trình.

Xử lý sau quá trình khử canxi và trước khi xử lý
Nhiều phương pháp khác nhau để trung hòa chất khử axit dư trước khi xử lý, bao gồm rửa sạch với nước hoặc sử dụng dung dịch kiềm. Điều quan trọng là phải loại bỏ phần lớn chất khử canxi để tránh làm nhiễm axit vào thuốc thử
Lựa chọn lịch trình phù hợp cho xương bị canxi hóa hoặc các mô bị canxi hóa khác
Khi khoáng chất đã được loại bỏ, có thể sử dụng lịch trình xử lý tiêu chuẩn. Cần phải lưu ý rằng mặc dù đã được khử canxi hoàn toàn nhưng xương, đặc biệt là xương đặc, sẽ chứa những vùng dày đặc cần được xử lý kỹ lưỡng. Tốt hơn là sử dụng một lịch trình quá dài hơn là quá ngắn và sẽ phụ thuộc vào tính chất và kích thước của mẫu vật. Áp suất thấp trong quá trình vùi paraffin sẽ cải thiện chất lượng của các khối hoàn thiện.
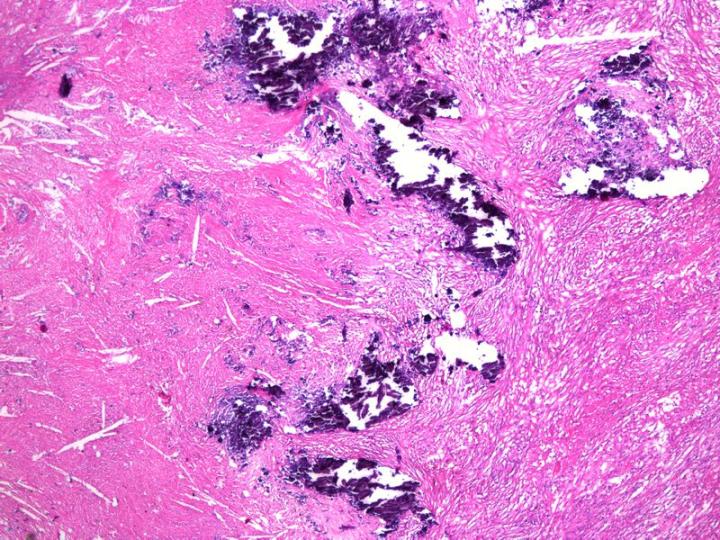
Khử keo bề mặt
Đây là phương pháp xử lý các cặn canxi nhỏ không mong muốn có thể xuất hiện trong các khối parafin (Hình 10). Thông thường, sau khi cắt khối trong máy cắt vi phẫu thì canxi được phát hiện. Điều quan trọng ở giai đoạn này là tránh làm gián đoạn bề mặt khối một cách rộng rãi. Sau đó, khối này có thể được lấy ra khỏi máy cắt vi phẫu và đặt úp xuống trong dung môi khử canxi trong 15 – 60 phút. Việc xử lý bề mặt này sẽ cho phép chất khử canxi thâm nhập một khoảng nhỏ vào khối và hòa tan canxi. Khối này sau đó có thể được rửa sạch trong nước để loại bỏ axit dư, làm lạnh và cắt thành từng phần. Cần phải căn chỉnh lại khối một cách cẩn thận vì chất khử canxi có thể xuyên qua một khoảng cách rất nhỏ vào khối, chỉ cho phép khử một vài phần.
Kết luận
Quá trình khử cặn canxi là một quá trình đơn giản nhưng để thực hiện tối ưu cần phải:
- Đánh giá sơ bộ mẫu vật
- Cố định mô kỹ càng
- Chuẩn bị các lát có độ dày hợp lý để cố định mô và xử lý mô
- Lựa chọn loại dung môi khử canxi phù hợp với thể tích vừa đủ, thay đổi thường xuyên
- Xác định cẩn thận điểm cuối của quá trình khử canxi
- Sử dụng lịch trình khử canxi phù hợp
Nguồn: https://www.leicabiosystems.com/knowledge-pathway/an-introduction-to-decalcification/
Minh Khang là nhà phân phối và nhập khẩu trực tiếp các thiết bị Giải phẫu bệnh từ hãng Leica Biosystems.


 EN
EN