Con người đã sử dụng các sản phẩm có nguồn gốc từ thực vật và động vật (thuốc sinh học) để điều trị bệnh trong hàng nghìn năm, nhưng sự ra đời của sản xuất dây chuyền trong thế kỷ 20 đã tạo điều kiện cho thuốc sinh học phổ biến hơn. Không giống như các loại thuốc có nguồn gốc hóa học, kết hợp các thành phần cụ thể theo một quy trình, thuốc sinh học thường là các phân tử rất lớn, phức tạp hoặc hỗn hợp các phân tử khó mô tả.
Trong những năm gần đây, thuốc sinh học đã đưa ra các phương pháp điều trị mới và mang lại kết quả thay đổi trên nhiều lĩnh vực điều trị. Các ví dụ chính về thuốc sinh học bao gồm:
- Vắc xin được sử dụng để tạo ra phản ứng miễn dịch mang lại sự bảo vệ chống lại nhiễm trùng hoặc bệnh tật.
- Protein trị liệu là phiên bản biến đổi gen của protein xuất hiện tự nhiên trong cơ thể, chẳng hạn như insulin. Chúng có thể được sử dụng để thay thế một loại protein bất thường hoặc bị thiếu hụt và có thể tăng cường cung cấp protein cho cơ thể để giúp giảm tác động của bệnh tật hoặc việc điều trị.
- Kháng thể đơn dòng, một loại protein trị liệu được thiết kế để đóng vai trò là kháng thể thay thế có thể khôi phục, tăng cường, sửa đổi hoặc mô phỏng sự tấn công của hệ miễn dịch đối với các tế bào không mong muốn, như các tế bào ung thư
- Các yếu tố tăng trưởng, kích thích các quá trình tế bào có thể hỗ trợ tái tạo mô.
- Bộ điều biến miễn dịch, hoạt động bằng cách kích thích hoặc ức chế hệ thống miễn dịch và có thể giúp cơ thể chống lại ung thư, nhiễm trùng hoặc các bệnh khác.
- Các sản phẩm khác có nguồn gốc từ máu và huyết tương người có nhiều chức năng và được kê toa cho nhiều bệnh khác nhau, chẳng hạn như các yếu tố đông máu, immunoglobin, chất ức chế albumin và protease.
Bảo đảm chất lượng trong sản xuất thuốc sinh học
Kiểm soát chất lượng là một lĩnh vực công việc quan trọng trong ngành dược phẩm, giúp đảm bảo hiệu quả của phương pháp điều trị cũng như hỗ trợ tính nhất quán của chúng giữa các lô và cuối cùng là duy trì sự an toàn cho bệnh nhân. Khi nói đến liệu pháp sinh học, bản chất của chúng đòi hỏi một cách tiếp cận kiên quyết để theo dõi và kiểm soát chất lượng. Việc sản xuất thuốc sinh học khai thác các hệ thống sống phức tạp có khả năng phản ứng cao ngay cả với những thay đổi tinh vi nhất trong quy trình sản xuất và môi trường của chúng. Những sai lệch nhỏ có thể làm thay đổi đáng kể các đặc tính của thuốc sinh học cuối cùng và ảnh hưởng đến cách thức hoạt động của thuốc sau khi được dùng cho bệnh nhân.
Một vấn đề quan trọng khác cần cân nhắc là duy trì tính vô trùng vì nhiều phương pháp điều trị sinh học được đưa trực tiếp vào máu. Sự ô nhiễm có thể xuất hiện theo nhiều cách, từ nguyên liệu thô ban đầu được sử dụng (ví dụ: tế bào, chất bổ sung), bề mặt của thiết bị, con người thực hiện quy trình sản xuất và vận chuyển nguyên liệu vào hoặc ra khỏi quy trình sản xuất vô trùng. Ngoài ra, việc sử dụng các nguyên liệu thô nhạy cảm như nuôi cấy tế bào làm cho sản phẩm sinh học dễ bị nhiễm chất gây ô nhiễm hơn các sản phẩm khác.
So sánh vắc xin dựa trên tế bào và vắc xin dựa trên mRNA có thể giúp minh họa nguyên tắc này: Việc sản xuất vắc xin dựa trên tế bào phụ thuộc vào các quá trình sinh học, đòi hỏi các xét nghiệm kiểm soát chất lượng bổ sung để phát hiện nhanh vi khuẩn có thể lây nhiễm vào tế bào trong vắc xin, chẳng hạn như mycoplasma. Mặt khác, vắc xin dựa trên mRNA được tạo ra thông qua các quy trình tổng hợp, do đó, mặc dù chúng có thể bị ô nhiễm theo những cách khác, nhưng các vấn đề như ô nhiễm mycoplasma không phải là vấn đề đáng lo ngại vì không có tế bào nào để lây nhiễm.
Một phần do tính chất độc đáo của chúng, việc mở rộng sinh học như một lớp trị liệu đã buộc các cơ quan quản lý phải phát triển và điều chỉnh các phương pháp tiếp cận của họ để phù hợp với cách chúng được phân loại và quản lý. Năm 1992, Tổ chức Y tế Thế giới (WHO) lần đầu tiên ban hành Thực hành sản xuất tốt cho các sản phẩm sinh học. Kể từ đó, WHO đã rút ra kinh nghiệm tập thể tích lũy được về sinh học để phát triển một bộ tiêu chuẩn quản lý toàn cầu, trong đó đặt ra các yêu cầu tối thiểu để phê duyệt tất cả các loại thuốc sinh học.
Ngoài ra, Cơ quan Dược phẩm Châu Âu đã đưa ra các hướng dẫn khoa học sâu rộng về thuốc sinh học để hỗ trợ việc nộp đơn xin cấp phép tiếp thị mới cho liệu pháp sinh học. Cục Quản lý Thực phẩm và Dược phẩm Hoa Kỳ cũng đã nhận ra tầm quan trọng ngày càng tăng của thuốc sinh học và khởi xướng lộ trình phê duyệt rút gọn cho các sản phẩm sinh học để đáp ứng.
Cách tiếp cận dựa trên rủi ro để thiết kế hệ thống chất lượng cho thuốc sinh học
Trong khi các quy định của ngành đưa ra các yêu cầu sản xuất tổng quát mà các công ty phải tuân thủ, thì các sản phẩm sinh học riêng lẻ đều được sản xuất theo những cách khác nhau, đòi hỏi cách tiếp cận dựa trên rủi ro để kiểm soát chất lượng ở mọi phần của chuỗi giá trị. Kiểm tra và giám sát là trọng tâm của việc kiểm soát chất lượng thành công; đảm bảo sản phẩm vẫn đáp ứng các thông số kỹ thuật cần thiết ở từng giai đoạn sản xuất, cho phép nhà sản xuất xác định bất kỳ nhu cầu nào về hành động khắc phục và đảm bảo đầu ra an toàn, hiệu quả và có chất lượng chấp nhận được khi đưa ra thị trường.
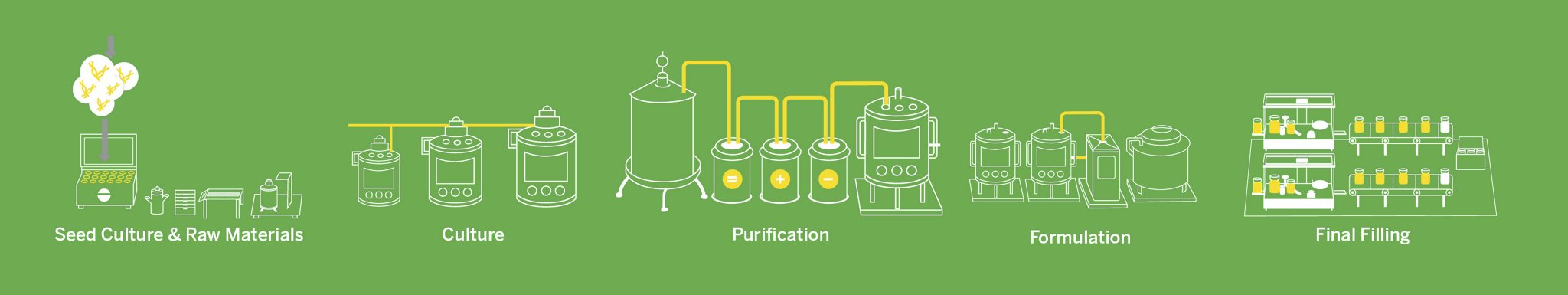
Trong khi việc sản xuất một loại thuốc có nguồn gốc hóa học có thể bao gồm 40-50 bài kiểm tra quan trọng thì đối với một sản phẩm sinh học, quy trình này có thể bao gồm 250 bài kiểm tra trở lên. Ở giai đoạn đầu (nuôi cấy tế bào, lên men), việc sử dụng các kỹ thuật phân tích hiệu quả để sàng lọc nguyên liệu thô sẽ đảm bảo nguyên liệu ban đầu có chất lượng cao. Việc theo dõi liên tục các thông số quan trọng như sự phát triển của tế bào, mức độ dinh dưỡng và chất chuyển hóa cho phép điều chỉnh kịp thời, tối ưu hóa các điều kiện nuôi cấy tế bào. Ngoài ra, việc triển khai thử nghiệm trong quá trình, như xét nghiệm dấu ấn sinh học, cho phép phát hiện sớm các sai lệch, đảm bảo tính nhất quán của sản phẩm.
Đối với giai đoạn cuối (tinh chế thuốc sinh học), các kỹ thuật có độ phân giải cao như sắc ký và khối phổ có thể nâng cao độ chính xác của quy trình tinh chế, đảm bảo loại bỏ tạp chất và đạt được độ tinh khiết cao của sản phẩm. Thử nghiệm mạnh mẽ về các thuộc tính chất lượng sản phẩm như hiệu lực và độ ổn định giúp xác nhận hiệu quả và thời hạn sử dụng của thuốc sinh học. Ngoài ra, việc sử dụng phân tích thời gian thực cho phép điều chỉnh ngay lập tức, tối ưu hóa hiệu quả của các hoạt động tiếp theo.
Cũng cần phải xem xét thêm các thử nghiệm và các biến thể trong cách tiếp cận tùy thuộc vào loại sinh phẩm được sản xuất.
Các phương pháp tiếp cận đang phát triển để kiểm soát và đảm bảo chất lượng cho một thế giới đang thay đổi
Xu hướng cho thấy thị trường thuốc sinh học toàn cầu sẽ tiếp tục mở rộng nhanh chóng trong những năm tới, với các nhà phân tích dự đoán nó sẽ tăng giá trị từ 367,17 tỷ USD vào năm 2023 lên hơn 620 tỷ USD vào năm 2032. Thách thức chính của sự tăng trưởng này là duy trì cân bằng cung cầu, khiến các doanh nghiệp phải đầu tư mở rộng năng lực sản xuất. Việc đưa ra các lộ trình xem xét và phê duyệt nhanh chóng cho các thuốc sinh học mới cũng đang tạo thêm áp lực lên các nhà sản xuất trong việc cắt giảm thời gian đưa sản phẩm của họ ra thị trường.
Một khía cạnh của công nghệ mới nổi có thể giúp nâng cao năng lực và đẩy nhanh quá trình sản xuất là phần mềm tiên tiến sử dụng trí tuệ nhân tạo (AI). Bằng cách tạo và phân tích dữ liệu, AI có thể giúp các nhà sản xuất nghiên cứu quy trình của họ và tạo ra các hệ thống bền vững và hiệu quả hơn, cũng như dự đoán nguồn cung với độ chính xác cao hơn. Bằng cách xây dựng vòng phản hồi hiệu quả, nhà sản xuất có thể áp dụng các bài học ở mọi giai đoạn của chuỗi giá trị để tập trung vào các lĩnh vực có tác động lớn nhất đến chất lượng và năng suất sản phẩm.
Thách thức trong việc tăng nguồn cung thuốc sinh học càng trở nên phức tạp hơn do tình trạng thiếu lao động đang diễn ra trong lĩnh vực này, khi các nhà sản xuất phải vật lộn để tìm người và giữ chân nhân viên có kinh nghiệm. Mặc dù không thể khắc phục nhanh chóng vấn đề này nhưng tự động hóa ngày càng được coi là một giải pháp tiềm năng để khắc phục những tắc nghẽn trước mắt, giảm sự phụ thuộc vào đội ngũ chuyên gia và có khả năng giảm bớt những hạn chế về năng lực. Việc tích hợp tự động hóa trong sản xuất thuốc sinh học cũng có thể mang lại lợi ích bổ sung là giảm lỗi của con người, loại bỏ cơ hội ô nhiễm và loại bỏ khả năng tiếp xúc với các vật liệu nguy hiểm.
Sự phát triển của thuốc sinh học như một lĩnh vực quan trọng của y học hiện đại là không thể phủ nhận, tuy nhiên việc duy trì niềm tin vào các phương pháp điều trị này phụ thuộc vào sự cảnh giác tổng hợp của các cơ quan quản lý và nhà sản xuất, cùng với sự đổi mới liên tục của các công cụ mạnh mẽ và nhất quán hơn để hỗ trợ kiểm tra kiểm soát chất lượng trong một cảnh quan đang phát triển. Thông qua tinh thần hợp tác này, chúng ta có thể tiếp tục khai thác tiềm năng của thuốc sinh học để cung cấp các lựa chọn điều trị mang tính thay đổi cho người kê đơn và cải thiện kết quả cho bệnh nhân của họ.
Công ty TNHH TM DV Kỹ thuật Minh Khang là nhà phân phối độc quyền giải pháp Dược phẩm hãng bioMérieux (Pháp).


 EN
EN