Giới thiệu
Báo cáo đầu tiên về protein huỳnh quang ở loài sứa hydrozoan Aequorea victoria đã được ghi nhận vào giữa thế kỷ 20 và chiết xuất protein đã được hai nhà nghiên cứu chứng minh độc lập là nguyên nhân gây ra hiện tượng phát huỳnh quang “xanh” vào những năm 1960 và 1970, 20 năm nữa và một số tiến bộ đáng kể trong công nghệ sinh học phân tử và tế bào chứng kiến sự làm sáng tỏ cấu trúc axit amin bậc một. Tiếp theo ngay sau đó là sự chứng minh rằng protein huỳnh quang xanh của sứa (GFP; Hình 1) có thể dễ dàng được sử dụng như một chất đánh dấu hữu ích cho sự biểu hiện gen trong các tế bào của sứa về mặt tiến hóa.
Trong vài năm tiếp theo, một số biến thể di truyền “nâng cao” có cấu hình quang phổ phát xạ huỳnh quang trải dài trên các vùng xanh lam, lục lam, lục lam và vàng của quang phổ khả kiến đã được phát triển bằng cách biến đổi các đột biến cụ thể thành trình tự nucleotide GFP ban đầu. Một trong những tiến bộ quan trọng nhất sau những nỗ lực nhân bản ban đầu và gây đột biến sớm đối với protein huỳnh quang xanh Aequorea victoria là việc phát hiện ra các protein tương tự ở san hô không phát quang sinh học và hải quỳ, chúng không chỉ cung cấp phổ màu phát xạ mới rộng lớn mà còn cũng chứng minh rằng những protein này xuất hiện ở nhiều loại sinh vật.
Trong thập kỷ qua, protein huỳnh quang đã mở ra một kỷ nguyên mới và chưa từng có trong sinh học tế bào bằng cách cho phép các nhà nghiên cứu áp dụng các phương pháp nhân bản phân tử thông thường, kết hợp các đầu dò quang học này với nhiều mục tiêu protein và enzyme khác nhau để theo dõi các quá trình tế bào sống bằng kính hiển vi huỳnh quang và phương pháp liên quan. Phổ ứng dụng của protein huỳnh quang bao gồm việc điều hòa phiên mã và các dấu hiệu mục tiêu cho các bào quan và các cấu trúc dưới tế bào khác đến các protein tổng hợp được tạo ra để theo dõi sự chuyển động và động lực học. Những đầu dò này cũng đã tạo ra các cảm biến sinh học cho nhiều hiện tượng nội bào, bao gồm sự dao động nồng độ pH và ion, hoạt động của protein kinase, apoptosis, điện áp và tín hiệu nucleotide tuần hoàn. Bằng cách áp dụng các chất xúc tiến và tín hiệu mục tiêu đã chọn, cảm biến sinh học protein huỳnh quang có thể được đưa vào một sinh vật nguyên vẹn và hướng đến một loạt các mô, loại tế bào cụ thể cũng như các ngăn dưới tế bào để cho phép tập trung chưa từng có vào việc theo dõi nhiều quá trình sinh lý khác nhau.
Khi kết hợp với những tiến bộ kỹ thuật gần đây trong huỳnh quang trường rộng và kính hiển vi đồng tiêu, bao gồm máy ảnh CCD kỹ thuật số mức ánh sáng yếu cực nhanh, đĩa quay, hệ thống chiếu sáng có cấu trúc và thiết bị quét trường, cũng như hệ thống quét laser đa rãnh với bộ lọc điều chỉnh quang âm(AOTF), protein huỳnh quang xanh và các dẫn xuất di truyền chuyển màu của nó đã chứng minh tính hữu ích vô giá trong hàng nghìn thí nghiệm chụp ảnh tế bào sống. So với nhiều loại fluorophores tổng hợp truyền thống, thường độc hại hoặc phản ứng quang học, việc sử dụng protein huỳnh quang ít xâm lấn đến tế bào sống, cho phép hiển thị và ghi lại chuỗi hình ảnh tua nhanh thời gian trong thời gian dài. Hơn nữa, những tiến bộ liên tục trong việc tinh chỉnh về mặt di truyền các đặc tính của các biến thể protein huỳnh quang đã dẫn đến mức độ sáng tăng lên, khả năng quang hóa được cải thiện và biểu hiện tốt hơn đáng kể trong tế bào động vật có vú. Những cải tiến về chức năng này đã thúc đẩy nhiều nghiên cứu khác nhau về động lực học và chức năng của protein bằng cách sử dụng máy ảnh protein huỳnh quang chụp ảnh ở cường độ ánh sáng yếu trong nhiều giờ để trích xuất thông tin có giá trị về những thay đổi trong phân bố trạng thái ổn định.
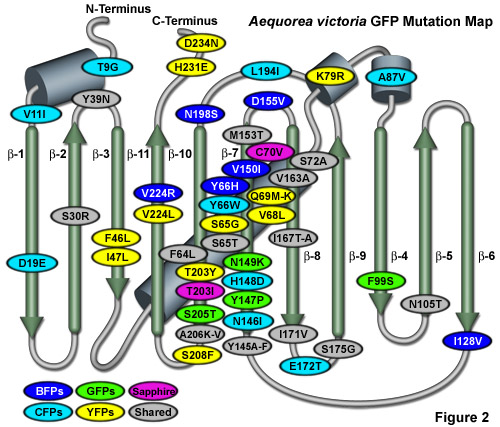
Minh họa trong Hình 2 là bản đồ đột biến GFP của Aequorea victoria cho thấy nhiều đột biến phổ biến được xếp chồng lên cách bố trí tôpô của cấu trúc peptit. Các tấm beta được đánh số và mô tả dưới dạng các hình trụ mỏng, màu xanh lá cây với một mũi tên hướng về phía đầu C, trong khi các vòng xoắn alpha được mô tả bằng các thùng màu xanh lam. Đột biến được mã hóa màu để thể hiện các biến thể mà chúng áp dụng: BFP (xanh dương), CFP (lục lam), GFP (xanh lá cây), YFP (vàng) và Sapphire (tím). Các đột biến gấp, chia sẻ và đơn phân hóa được biểu thị bằng các hình elip màu xám. Lưu ý rằng gần 75% đột biến nằm ở chuỗi xoắn trung tâm và dải beta 7, 8 và 10. Nói chung, đột biến đặc trưng theo bước sóng xảy ra gần chuỗi xoắn trung tâm chứa nhiễm sắc thể, trong khi đột biến gấp xảy ra trong suốt chuỗi.
MẶc dù có những tiến bộ mới trong công nghệ protein huỳnh quang, hầu hết các nhóm nghiên cứu trên khắp thế giới vẫn đang sử dụng phương pháp nâng cao của GFP là EGFP, cũng như các dẫn xuất màu lục lam và màu vàng ban đầu, như phương pháp chính cho phần lớn các nghiên cứu được công bố về sinh học tế bào. Bởi sự sẵn có của các protein này, nhiều nhà nghiên cứu được thúc đẩy để chuyển sang các biến thể protein huỳnh quang mới, nhưng không hoàn toàn đảm bảo về cải thiện độ sáng, khả năng quang hóa, đặc tính đơn phân và tiện ích trong phản ứng tổng hợp. Trong nhiều trường hợp, việc tìm ra nguồn protein huỳnh quang mới hoặc vectơ tổng hợp có thể là một thách thức về thời gian. Việc thiếu tính sẵn có thường đòi hỏi các nhà nghiên cứu phải dựa vào phòng thí nghiệm ban đầu, do đó, có thể bị quá tải bởi hàng loạt yêu cầu ngay sau khi một cấu trúc protein, cảm biến sinh học hoặc phản ứng tổng hợp mới được báo cáo. Việc triển khai một hệ thống có hiệu quả để phân phối các biến thể protein huỳnh quang cho cộng đồng khoa học sẽ khó thực hiện trong tương lại gần.
Những nhà nghiên cứu cuối cùng có thể thu được các dẫn xuất protein huỳnh quang mới có thể cho ra kết quả không như mong muốn khi so sánh protein mới với các dẫn xuất GFP. Các cấu trúc phản ứng tổng hợp thường bị cản trở bởi sự kết tụ, mức độ sáng thấp và quá trình tẩy quang nhanh hoặc có thể không nhắm mục tiêu vào một cơ quan cụ thể như các biến thể Aequorea GFP cổ điển. Không có gì lạ khi các nhà phát triển protein nhận được phản hồi dưới dạng: “protein mới (chọn màu) này hình thành tập hợp trong tế bào chất, cũng không tạo thành cấu trúc chính xác và mờ hơn nhiều so với các cấu trúc GFP khác và không thể sử dụng nó để chụp ảnh nhiều màu như mong đợi.
Cấu trúc protein huỳnh quang xanh
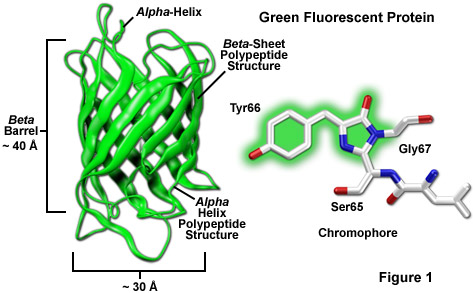
Trong số các thuộc tính đáng chú ý nhất của protein quang xanh ban đầu có nguồn gốc từ loài sứa Aequorea victoria , cũng như bảng màu được phát triển gần đây hơn của các biến thể di truyền chuyển màu, đó là cấu trúc polypeptide hình trụ ổn định và có độ xác định cao là điều cần thiết cho sự phát triển và duy trì huỳnh quang trong họ protein rất đặc biệt này. Fluorophore chính (thường được gọi là chromophore) trong GFP là một tripeptide bao gồm các gốc serine, tyrosine và glycine ở vị trí 65-67 trong trình tự. Mặc dù mô típ axit amin đơn giản này thường được tìm thấy trong tự nhiên nhưng nhìn chung nó không tạo ra huỳnh quang. Nhiễm sắc thể hình thành một cách tự nhiên sau khi dịch mã mà không cần đến các đồng yếu tố hoặc các thành phần enzyme bên ngoài (trừ oxy phân tử), thông qua sự sắp xếp lại nội phân tử tự xúc tác của trình tự tripeptide để tạo ra các loại huỳnh quang (như được minh họa trong Hình 1 và Hình 3 tương ứng cho biến thể GFP và biến thể nâng cao xuất hiện tự nhiên).
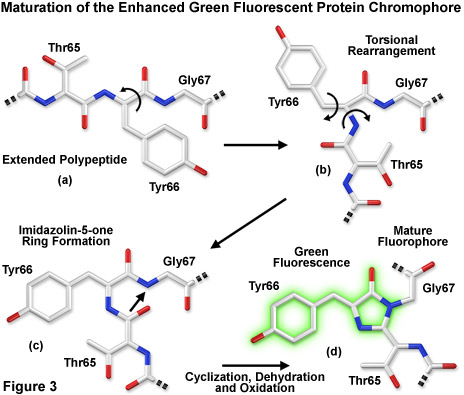
Cấu trúc dạng thùng beta (được mô tả chi tiết hơn bên dưới) cung cấp một protein xuyên màng quanh fluorophore để duy trì tính phẳng và thúc đẩy một loạt các tương tác với các phân tử nước bị mắc kẹt và chuỗi bên axit amin từ xương sống polypeptide. Kết hợp với các phần ngắn của chuỗi xoắn alpha và các vòng ở hai đầu thùng (Hình 1), toàn bộ cấu trúc đóng vai trò như một lá chắn chống lại tác hại của môi trường đối với fluorophore. Về vấn đề này, yêu cầu về oxy phân tử làm chất xúc tác kích hoạt fluorophore và hình thành hệ thống cảm biến huỳnh quang, loại trừ các xúc tác với fluorophore để tránh tắt huỳnh quang do va chạm. Tốc độ quang hóa thấp của protein huỳnh quang cung cấp sự ổn định lâu dài và năng suất lượng tử cao hơn.
Một số khía cạnh vật lý và hóa học cơ bản của nhiễm sắc thể protein huỳnh quang có ý nghĩa sâu sắc đối với việc ứng dụng các phân tử sinh học này làm đầu dò nội bào. Khía cạnh nổi bật nhất là mặc dù sự hiện diện của chúng cho đến nay chỉ được phát hiện ở các sinh vật biển nhưng chúng có thể hình thành các đơn vị chức năng trong nhiều loại sinh vật khác nhau, từ vi khuẩn, thực vật đến động vật có vú. Aequorea victoria GFP bản địa bao gồm một protein miền đơn với 238 axit amin và trọng lượng phân tử khoảng 27 kiloDalton. Mặc dù quang vật lý của GFP khá phức tạp nhưng cấu trúc phân tử của protein khá chắc chắn và có thể đáp ứng mức độ biến đổi cao (được thực hiện thông qua trình tự axit amin) mà không phá hủy khả năng phát huỳnh quang.
Các protein huỳnh quang, hoặc ít nhất là các chromoprotein mang cấu trúc thùng beta 11 sợi phổ biến có khả năng tạo ra protein huỳnh quang thông qua quá trình gây đột biến, đã được phát hiện ở các sinh vật từ động vật không xương sống ở biển đến động vật giáp xác và có thể tồn tại ở nhiều loài khác. Trên thực tế, một loại protein được gọi là nidogen, ẩn sâu trong màng đáy của tất cả các loài động vật có vú, được đặc trưng là có một vùng chứa cấu trúc ba chiều tương tự như GFP, mặc dù chỉ có 10% trình tự tương đồng. Ở nidogen, bộ ba axit amin Ile – Gly – Gly ( IGG ) thay thế các gốc hình thành nhiễm sắc thể Ser – Tyr – Gly (SYG) được tìm thấy trong GFP. Ngoài ra, một số dư lượng khác rất quan trọng cho việc tạo ra nhiễm sắc thể chức năng trong protein huỳnh quang đã được thay thế trong nidogen bằng các dư lượng loại bỏ khả năng phát huỳnh quang. Tuy nhiên, cấu trúc thùng beta dường như đã được bảo tồn về mặt tiến hóa cho nhiều mục đích khác ngoài huỳnh quang và thiên nhiên có thể làm chúng ta ngạc nhiên một lần nữa với nguồn chromoprotein và protein huỳnh quang mới ở các loài trước đây chưa được xem xét.
Hình dạng hình trụ được bảo tồn tốt của tất cả các protein huỳnh quang được phát hiện cho đến nay dường như phù hợp một cách lý tưởng với chức năng chính là bảo vệ nhiễm sắc thể. Được tạo thành dưới dạng hình trụ có kích thước khoảng 30 x 40 Angstrom (xem Hình 1), khung polypeptide được quấn thành 11 sợi của tấm beta liên kết hydro rộng rãi bao quanh chuỗi xoắn alpha trung tâm chứa nhiễm sắc thể với các đoạn xoắn ốc ngắn nhô ra từ hai đầu của hình trụ. Được mệnh danh là beta-can (hoặc beta-barrel) vì tính đối xứng hình học, việc đóng gói chặt chẽ các gốc axit amin mang lại mức độ ổn định cao cho protein, điều này thường mang lại hiệu suất lượng tử huỳnh quang tương đối lớn cho GFP và các dẫn xuất của nó (lên tới 80%).
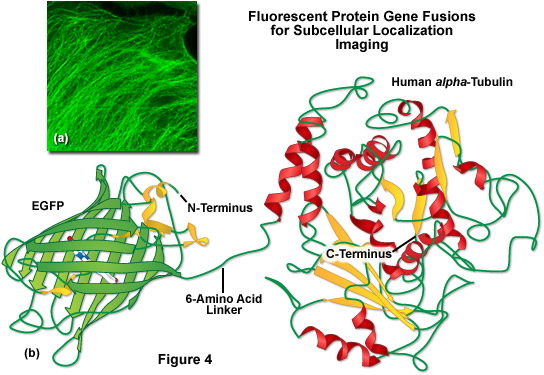
Việc thiếu các khe hở và khoảng trống để tiếp cận các phối tử nhỏ (chẳng hạn như ion và oxy), kết hợp với thực tế là nhiễm sắc thể nằm gần trung tâm chính xác của protein, giải thích một phần khả năng quang hóa đặc biệt và năng suất lượng tử cao được quan sát thấy. Ngoài ra, hai đầu N và C ở trên bề mặt của thùng beta để dễ dàng tham gia vào quá trình tổng hợp protein mà không ảnh hưởng đến tính toàn vẹn cấu trúc (Hình 4). Mô típ tổ chức protein hợp nhất này cũng tăng cường khả năng chống lại những thay đổi về độ pH, nhiệt độ, sự cố định với paraformaldehyde và tác động phá vỡ của nhiều tác nhân biến tính phổ biến, chẳng hạn như urê và guanidine hydrochloride. Các đột biến trong trình tự axit amin ảnh hưởng đến cấu hình huỳnh quang nói chung cũng tạo ra những tác động tiêu cực đến độ ổn định tổng thể, thường dẫn đến giảm hiệu suất lượng tử, tăng tốc độ tẩy quang và tăng cường độ nhạy môi trường.
Được minh họa trong Hình 4(b) là bản vẽ cấu trúc hợp nhất của EGFP với alpha -tubulin của con người, một trong những thiết bị thăm dò định vị dưới tế bào phổ biến được sử dụng rộng rãi để kiểm tra động lực học của vi ống. Một trình liên kết peptide ngắn chứa sáu gốc axit amin kết nối đầu C của EGFP với đầu N của alpha -tubulin, và toàn bộ đơn vị được phiên mã và dịch thành một polypeptide duy nhất với mỗi miền được lắp ráp độc lập. Trong phản ứng tổng hợp lý tưởng, protein huỳnh quang được tách biệt đủ tốt khỏi protein mục tiêu (với một trình liên kết axit amin ngắn) để nó không ảnh hưởng đến chức năng protein bình thường. Trong trường hợp alpha-tubulin, thể khảm EGFP định vị chính xác thành các vi ống (Hình 4(a)), nhưng đã được chứng minh là cản trở động lực học bình thường của tubulin trong một số nghiên cứu. Sự kết hợp với alpha -tubulin yêu cầu không có quá trình oligome hóa đối với protein huỳnh quang đính kèm và do đó, đây là một cấu trúc tuyệt vời để kiểm tra đặc tính đơn phân.
Tính chất quang phổ của protein huỳnh quang
Trong cấu trúc thùng beta protein huỳnh quang, khoang chứa nhiễm sắc thể được lót bằng một số gốc axit amin tích điện ở ngay gần nhiễm sắc thể và chứa các phân tử nước đóng vai trò quan trọng trong việc thiết lập mạng lưới liên kết hydro bao quanh nhiễm sắc thể. Mạng lưới gồm các chuỗi bên axit amin tích điện và các phân tử nước, cùng với van der Waals, xếp chồng quỹ đạo π và tương tác kỵ nước với các axit amin khác trong khu vực, rất quan trọng trong việc thiết lập các đặc tính quang hóa và quang phổ động của GFP và các dẫn xuất của nó. Các đột biến làm thay đổi trực tiếp cấu trúc cộng hóa trị của nhiễm sắc thể hoặc làm thay đổi đáng kể môi trường vi mô xung quanh, thường có ảnh hưởng sâu sắc đến các đặc tính quang phổ (cấu hình hấp thụ và phát xạ) của protein huỳnh quang. Nhiều đột biến có ảnh hưởng thuận lợi đến các đặc tính quang phổ và tính gấp của các dẫn xuất GFP nằm ở khoảng 20 gốc cách nhau trong suốt trình tự (xem Hình 2), nhưng thường là những thay thế tương đối thận trọng. Mặc dù có nhiều loại đột biến dẫn đến mất hoàn toàn khả năng phát huỳnh quang, có lẽ là do nhiễm sắc thể bị bất hoạt, nhưng hầu hết vẫn không bị ảnh hưởng mặc dù việc điều tra cẩn thận có thể hỗ trợ làm sáng tỏ các dư lượng quan trọng trong quá trình hình thành nếp gấp và nhiễm sắc thể.
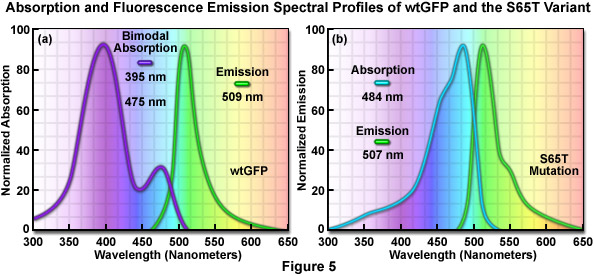
Phổ phát xạ tương tự được tạo ra bởi sự kích thích chọn lọc của loại trung tính (395 nanomet) hoặc loại anion (475 nanomet) của GFP được cho là oxy phenolic của tyrosine nhiễm sắc thể ở vị trí 66 (Tyr66 ; Hình 1 và 3) ở trạng thái kích thích có tính axit cao hơn ở trạng thái cơ bản. Do đó, do hiện tượng được gọi là chuyển proton ở trạng thái kích thích (ESPT), trạng thái kích thích anion phổ biến xảy ra ở GFP và chịu trách nhiệm cho các đặc tính phát xạ huỳnh quang. Khi sự hấp thụ và phát xạ ánh sáng được tạo ra theo chu kỳ bằng sự kích thích định kỳ, sự chuyển giao proton cuối cùng sẽ đảo ngược khi ngừng chiếu xạ. Tuy nhiên, khi bức xạ bằng ánh sáng cực tím cường độ cao, một tỷ lệ phần trăm các nhiễm sắc thể vẫn bị ion hóa (đồng phân quang hóa) và mức hấp thụ tối đa 395 nanomet giảm khi đồng thời tăng ở đỉnh 475 nanomet. Trước khi chiếu sáng, GFP kiểu hoang dã có tỷ lệ khoảng sáu trung tính cho mỗi loại anion, nhưng với đủ ánh sáng cực tím, tỷ lệ phân tử anion có thể tăng lên gấp nhiều lần. Trong nhiều ứng dụng sinh học, sự cùng tồn tại của các nhiễm sắc thể hỗn hợp có hai đỉnh kích thích có nhiều nhược điểm. Đáng chú ý nhất trong số này là hiệu ứng quang đồng phân hóa làm giảm đáng kể khả năng thu thập hình ảnh định lượng.
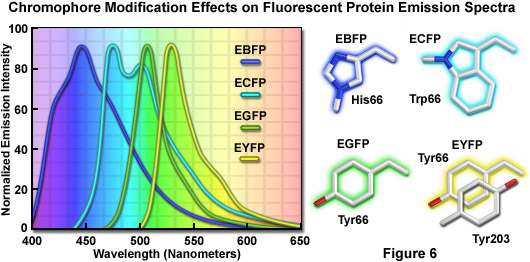
Việc phát hiện ra rằng sự thay thế nhiễm sắc thể GFP của threonine bằng serine ở vị trí 65 (S65T ; được gọi là protein huỳnh quang màu lục tăng cường , EGFG) đã tạo ra một biến thể được cải tiến đáng kể với phổ kích thích và phát xạ đơn giản (Hình 5(b)) dẫn đến một loại fluorophores mới sáng hơn phù hợp hơn cho nghiên cứu sinh học. Ở đột biến GFP cải tiến, sáng gấp đôi so với GFP tự nhiên, phổ hấp thụ có một đỉnh duy nhất ở 484 nanomet với mức phát xạ tối đa ở 507 nanomet. Hơn nữa, các cấu hình quang phổ này không bị thay đổi khi chiếu sáng kéo dài hoặc lặp đi lặp lại. Một ưu điểm khác của EGFP là fluorophore có thể dễ dàng được kích thích bằng tia laser 488 nanomet thông dụng và phổ biến và huỳnh quang có thể được theo dõi bằng bộ lọc FITC tiêu chuẩn. Một loạt các biến thể nâng cao, có màu phát xạ từ xanh dương đến xanh lục vàng, đã được tạo ra từ các dẫn xuất của protein Aequorea victoria ban đầu (xem Hình 6). Nhìn chung, phổ hấp thụ và phát xạ của các protein này rất rộng và không có gì đặc biệt, thường trải dài trong dải bước sóng từ 100 đến 200 nanomet. Mặc dù các cấu hình quang phổ rộng này cho phép phạm vi rộng lớn trong việc lựa chọn các bộ lọc kích thích và phát xạ cho kính hiển vi huỳnh quang, nhưng chúng cũng làm tăng mức độ lan truyền quang phổ khi hai hoặc nhiều protein huỳnh quang được kết hợp trong các thí nghiệm hình ảnh nhiều màu.
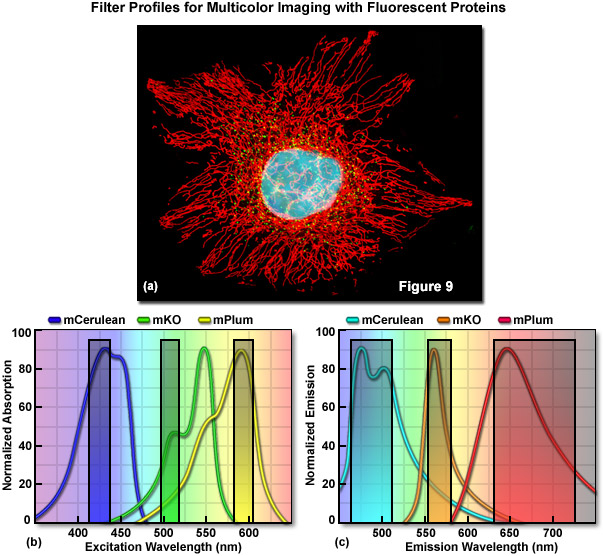
Một cách thực tế, băng thông của các đỉnh hấp thụ và phát xạ là yếu tố quan trọng cần cân nhắc trong việc xác định số lượng màu sắc khác biệt về mặt quang phổ và do đó có thể được sử dụng đồng thời trong các tình huống chụp ảnh nhiều màu. Nói một cách đại khái, hiện có khoảng 10 màu phát xạ khác nhau của protein huỳnh quang với độ dịch chuyển Stoke ngắn (được định nghĩa là khoảng cách tính bằng nanomet giữa bước sóng cực đại hấp thụ và phát xạ của chất huỳnh quang) và cực đại phát xạ cách nhau 20 nanomet trong khoảng 450-650 nanomet. Những màu này bao gồm: xanh lam (~450 nanomet), lục lam (~470 nanomet), xanh mòng két (~490 nanomet), xanh lục (~510 nanomet), vàng (~530 nanomet), vàng cam (~550 nanomet), cam ( ~570 nanomet), đỏ cam (~590 nanomet), đỏ (~610 nanomet) và đỏ xa (>630 nanomet). Có một số protein huỳnh quang Stoke shift dài bổ sung như Sapphire và Keima, nên được coi là các lớp màu bổ sung. Tuy nhiên, do các đỉnh kích thích và phát xạ tương đối rộng được chia sẻ bởi tất cả các protein huỳnh quang, nên việc chụp ảnh đồng thời ba (Hình 9) hoặc bốn màu riêng biệt (chẳng hạn như lục lam, vàng và đỏ hoặc xanh lam, xanh lục, cam, và màu đỏ xa) bằng hệ thống kính hiển vi dựa trên bộ lọc thông dải. Tuy nhiên, nguyên lý này không phải lúc nào cũng đúng vì người ta đã thu được hình ảnh của sáu màu riêng biệt bằng cách sử dụng một vạch laser duy nhất để kích thích và tách quang phổ của phát xạ.
Độ sáng và giai đoạn biểu hiện của protein huỳnh quang
Khi thiết kế các thí nghiệm sử dụng protein huỳnh quang, các nhà điều tra phải đảm bảo đạt được mức tín hiệu cao nhất có thể, đặc biệt trong trường hợp các loài mục tiêu bị đảo lộn nhanh chóng hoặc có mức độ phong phú quần thể tổng thể thấp. Độ sáng biểu kiến của protein huỳnh quang, một khái niệm có vẻ định tính, được xác định bởi một số yếu tố bao gồm hiệu quả và tốc độ trưởng thành, mức độ biểu hiện protein, các giá trị hệ số tuyệt chủng mol trong phạm vi bước sóng kích thích và năng suất lượng tử . Ngoài ra, sự kết hợp bộ lọc huỳnh quang, phân bố quang phổ của nguồn chiếu sáng và các thông số máy ảnh kỹ thuật số được sử dụng để chụp ảnh protein huỳnh quang là hết sức quan trọng trong việc xác định xem có thể đạt được độ tương phản và tỷ lệ tín hiệu trên nhiễu thích hợp hay không.
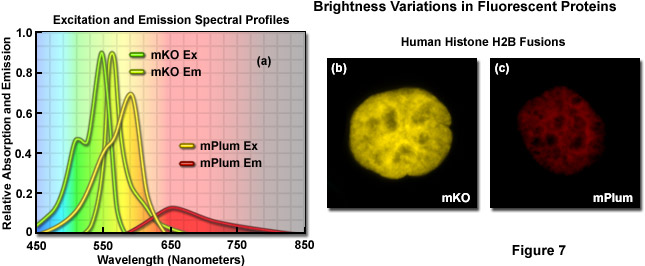
Minh họa trong Hình 7 là sự thay đổi độ sáng giữa hai protein huỳnh quang có nguồn gốc từ san hô rạn san hô được thể hiện bằng hình ảnh và kiểm tra cấu hình quang phổ. Kusabira Orange là một protein đơn phân (viết tắt mKO) có độ hấp thụ tối đa ở 548 nanomet và mức phát xạ tối đa là 559 nanomet. Độ tuyệt chủng mol và hiệu suất lượng tử của mKO lần lượt là 63.800 M -1 và 0,60, khiến protein huỳnh quang sáng hơn khoảng 90% so với EGFP. Ngược lại, mPlum (Hình 7(c)) chỉ sáng bằng 10% so với EGFP do hệ số tuyệt chủng thấp hơn (41.000M -1) và năng suất lượng tử (0,10). So sánh cấu hình quang phổ của mKO và mPlum được trình bày trong Hình 7(a). Lưu ý cường độ tích hợp tương đối nhỏ đối với cấu hình phát xạ của mPlum so với mKO, điều này là do sự khác biệt về năng suất lượng tử. Hình ảnh của hai protein huỳnh quang kết hợp với histone H2B của người được trình bày trong Hình 7(b) và 7(c). Ở các mức biểu hiện tương tự, khi thời gian phơi sáng và mức tăng của máy ảnh được giữ không đổi, hình ảnh của mKO có cường độ cao hơn đáng kể so với hình ảnh của mPlum. Do đó, trong những điều kiện tương tự, hình ảnh của các tế bào biểu thị mKO có thể được cho là có tín hiệu trên tạp âm lớn hơn so với hình ảnh từ các tế bào biểu thị mPlum.
Hiệu suất trưởng thành của protein huỳnh quang cũng được xác định bởi một số biến số, bao gồm nguồn gốc sinh học của protein và sự phong phú của các codon tối ưu đặc trưng cho loài trong sinh vật được chọn để biểu hiện. Nhìn chung, các protein huỳnh quang đã được tối ưu hóa codon để biểu hiện trong tế bào động vật có vú sẽ được biểu hiện với hiệu suất cao và trưởng thành nhanh chóng ở 37°C, mặc dù một tỷ lệ nhỏ sản phẩm có thể không gấp lại chính xác, dẫn đến khả năng nhắm mục tiêu kém và huỳnh quang nền cao . Nhiều biến thể protein có nguồn gốc từ protein huỳnh quang màu xanh lục ban đầu của sứa Aequorea đã được tối ưu hóa (liên quan đến GFP) thông qua quá trình gây đột biến để biểu hiện ở hệ thống động vật có vú với hiệu quả cao. Protein huỳnh quang từ san hô rạn san hô và hải quỳ thường biểu hiện tốt ở nhiệt độ 37°C, có lẽ là do các loài bản địa thu được protein đã tiến hóa ở môi trường sống ấm hơn. Sự hiện diện của oxy phân tử cũng là một yếu tố quan trọng trong sự phát triển nhiễm sắc thể protein huỳnh quang trong quá trình biểu hiện. Trong quá trình hình thành các nhiễm sắc thể trong các biến thể protein Aequorea, cần ít nhất một phân tử oxy để khử hydro, trong khi các protein san hô rạn san hô phát ra trong vùng quang phổ màu đỏ cam thường cần hai phân tử. Trong nuôi cấy tế bào động vật có vú, sự biểu hiện protein huỳnh quang hiếm khi bị cản trở do thiếu oxy, nhưng tình trạng thiếu oxy có thể trở thành yếu tố hạn chế trong các hệ thống khác.
Sự kết hợp bộ lọc huỳnh quang cho protein huỳnh quang
Bất kể độ sáng được hiển thị bởi một loại protein huỳnh quang cụ thể, khả năng đạt được mức tín hiệu cao trong kính hiển vi quang học chủ yếu được xác định bởi cấu hình của thiết bị chụp ảnh. Phổ vạch của hệ thống laser hoặc đèn plasma phóng điện hồ quang kết hợp với các bộ lọc huỳnh quang được sử dụng để kích thích protein huỳnh quang sẽ chồng lên nhau mạnh mẽ trên cấu hình hấp thụ của nhiễm sắc thể. Bộ lọc phát xạ phải có vùng dải thông rộng nhất có thể trùng với phổ phát xạ của protein huỳnh quang. Ngoài ra, hệ thống camera phải có khả năng ghi lại hình ảnh có hiệu suất lượng tử cao trong vùng phát xạ huỳnh quang quan tâm và hệ thống quang học của kính hiển vi phải có thông lượng cao trong các dải bước sóng cần thiết để tạo ra sự kích thích và thu thập phát xạ. Ngay cả với thiết bị ở cấp độ nghiên cứu, thường rất khó đạt được mức độ sáng protein huỳnh quang tiềm năng tối đa trong mỗi loại quang phổ trừ khi bộ lọc huỳnh quang được tối ưu hóa hoàn toàn để chụp ảnh protein. Nhiều cơ sở hình ảnh cốt lõi có số lượng bộ lọc hạn chế thường được thiết kế cho các chất huỳnh quang tổng hợp truyền thống thay vì các protein huỳnh quang. Ví dụ: các kết hợp bộ lọc huỳnh quang DAPI, FITC, TRITC và Texas Red tiêu chuẩn, thường được bán trên thị trường theo mặc định với kính hiển vi phóng điện hồ quang trường rộng, không phù hợp với nhiều protein huỳnh quang và kém tối ưu hơn cho các loại khác.
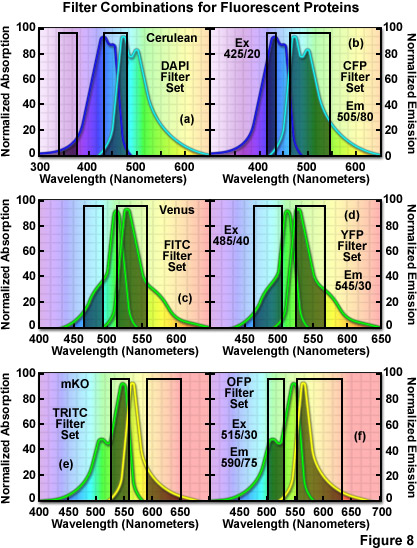
Bộ lọc FITC tiêu chuẩn phù hợp hơn nhiều với đặc tính hấp thụ của protein huỳnh quang màu vàng, Venus (Hình 8(c)), nhưng sự kết hợp tốt hơn sẽ làm tăng băng thông của bộ lọc kích thích lên 40 nanomet và di chuyển bước sóng trung tâm lên 485 nanomet ( dịch chuyển màu đỏ 5 nanomet; Hình 8(d)). Băng thông bộ lọc phát xạ tối ưu cho sao Kim tương tự phiên bản FITC với bước sóng trung tâm tăng thêm 10 nanomet. Hầu hết các protein huỳnh quang màu xanh lá cây và màu vàng có thể được chụp ảnh một cách thỏa đáng bằng bộ lọc FITC, nhưng hình ảnh định lượng mang lại lợi ích từ việc tối ưu hóa bước sóng và băng thông trung tâm cho từng protein. Các protein huỳnh quang màu cam có cấu hình quang phổ nằm giữa vùng bước sóng của bộ lọc FITC và TRITC để kích thích và thu phát xạ tối ưu. Hình ảnh mKusabira Orange với sự kết hợp bộ lọc TRITC (Hình 8(e)) là một ví dụ điển hình về sự không khớp. Bộ lọc kích thích TRITC bao phủ một mặt cắt ngang có thể chấp nhận được của phổ hấp thụ, nhưng vùng dải thông phát xạ bị dịch chuyển hơi quá xa về phía bước sóng phát xạ dài hơn cường độ thấp (Hình 8(e)). Ngoài ra, bộ lọc phát xạ cho bộ này chỉ thu được một phần nhỏ “đuôi” phổ phát xạ protein huỳnh quang, dẫn đến mất tín hiệu. Bộ lọc hiệu quả hơn cho mKusabira Orange được minh họa trong Hình 8(f). May mắn thay, phần lớn các protein huỳnh quang màu đỏ (bao gồm DsRed, mCherry, JRed, tdTomato và mPlum) có thể được chụp ảnh với kết quả tốt bằng cách sử dụng kết hợp bộ lọc TRITC hoặc Texas Red.
Độc tính quang và khả năng quang hóa
Ngoài độc tính xảy ra do nồng độ quá cao của fluorophores tổng hợp và sự biểu hiện hoặc tập hợp quá mức của các protein huỳnh quang định vị kém, sức khỏe và tuổi thọ của các tế bào động vật có vú được dán nhãn tối ưu trong buồng chụp ảnh kính hiển vi cũng có thể bị ảnh hưởng bởi một số yếu tố có hại khác. Đầu tiên trong số này là tổn thương do ánh sáng (nhiễm độc quang) xảy ra khi tế bào được dán nhãn huỳnh quang tiếp xúc nhiều lần với ánh sáng từ tia laze và đèn phóng điện hồ quang cường độ cao. Ở trạng thái kích thích, các phân tử huỳnh quang có xu hướng phản ứng với oxy phân tử để tạo ra các gốc tự do có thể phá hủy các thành phần dưới tế bào và làm tổn hại toàn bộ tế bào. Ngoài ra, một số báo cáo cho rằng các thành phần đặc biệt của môi trường nuôi cấy tiêu chuẩn, bao gồm vitamin riboflavin và axit amin tryptophan, cũng có thể góp phần gây ra tác động bất lợi do ánh sáng gây ra lên tế bào nuôi cấy. Các protein huỳnh quang, do các fluorophores của chúng được chôn sâu trong lớp vỏ polypeptide bảo vệ, nên thường không gây độc quang cho tế bào. Ngược lại, nhiều chất fluorophores tổng hợp phổ biến, chẳng hạn như MitoTracker và hầu hết các chất nhuộm hạt nhân (bao gồm thuốc nhuộm Hoechst, SYTO cyanine và DRAQ5), có thể gây độc tính cao cho tế bào khi được chiếu sáng trong thời gian tương đối ngắn. Khi thiết kế các thí nghiệm, nên chọn các fluorophores tổng hợp cũng như các protein huỳnh quang thể hiện bước sóng kích thích dài nhất có thể để giảm thiểu thiệt hại cho tế bào do chiếu sáng bước sóng ngắn. Do đó, thay vì tạo ra các sản phẩm nhiệt hạch có protein huỳnh quang màu xanh lam hoặc lục lam (được kích thích tương ứng bởi ánh sáng cực tím và xanh lam), các biến thể phát ra ở các vùng màu vàng, cam và đỏ của quang phổ nên được sử dụng thay thế khi có thể.
Các nhà nghiên cứu nên thực hiện cẩn thận thí nghiệm kiểm soát cần thiết khi sử dụng các biến thể protein huỳnh quang mới, vectơ protein tổng hợp khảm và các dòng tế bào để đảm bảo rằng các hiện tượng gây độc tế bào và quang độc không che khuất các hiện tượng sinh học quan trọng. Trong một số trường hợp, thuốc thử lipophilic gây ra các tác động có hại có thể bị nhầm lẫn với độc tính của protein huỳnh quang trong quá trình chụp ảnh ở các dòng tế bào sau quá trình truyền thoáng qua. Các protein huỳnh quang oligomeric (được thảo luận dưới đây) từ san hô có xu hướng hình thành các tập hợp lớn hơn nhiều (kết hợp với khả năng định vị dưới tế bào kém) so với các protein sứa đơn phân hoặc dimeric yếu, nhưng các sản phẩm tổng hợp được gấp không đúng cách có thể xảy ra với bất kỳ biến thể nào. Gần đây, một loại protein huỳnh quang có khả năng tạo ra các loại oxy phản ứng (ROS) khi chiếu sáng bằng ánh sáng xanh đã được báo cáo là tác nhân hiệu quả để vô hiệu hóa các protein cụ thể bằng cách bất hoạt ánh sáng hỗ trợ nhiễm sắc thể (CALI) và liệu pháp quang động. Được đặt tên thích hợp là KillerRed, chất cảm quang được mã hóa di truyền này có khả năng tiêu diệt cả vi khuẩn và tế bào nhân chuẩn khi chiếu sáng trong kính hiển vi. Các nghiên cứu trước đây về độc tính quang GFP chỉ ra rằng ngay cả thông qua nhiễm sắc thể có khả năng tạo ra oxy cấp đơn, đầu dò vẫn hoạt động kém hiệu quả như một chất cảm quang. Tuy nhiên, việc chiếu sáng kéo dài các tế bào biểu hiện GFP và các biến thể của nó có thể dẫn đến những thay đổi sinh lý và cuối cùng là chết tế bào, một tín hiệu rõ ràng về khả năng nhiễm độc quang trong các thí nghiệm chụp ảnh dài hạn.
Trong các thí nghiệm tế bào sống, protein huỳnh quang rất có lợi cho việc tạo ảnh mở rộng do tốc độ tẩy quang giảm khi so sánh với fluorophores tổng hợp. Mặc dù có mức độ biến đổi không tương quan cao giữa các protein huỳnh quang về khả năng quang hóa, nhưng hầu hết các biến thể đều hữu ích cho việc chụp ảnh ngắn hạn (từ 1 đến 25 lần chụp), trong khi một số protein kháng quang hơn có thể được sử dụng trong các chuỗi thời gian trôi đi. khoảng thời gian từ 24 giờ trở lên (trong đó hàng trăm đến hàng nghìn hình ảnh được thu thập). Tuy nhiên, độ ổn định lâu dài của bất kỳ protein cụ thể nào phải được nghiên cứu cho mọi kịch bản chiếu sáng (trường rộng, tiêu điểm, đa photon, đĩa quay, trường quét, v.v.) vì sự khác biệt về khả năng quang hóa thường được quan sát thấy với cùng một protein khi chiếu sáng được tạo ra bằng đèn phóng điện hồ quang so với hệ thống laser. Do đó, xét về khả năng quang hóa, việc lựa chọn protein huỳnh quang được quyết định bởi nhiều thông số, bao gồm điều kiện chiếu sáng, hệ thống biểu hiện và hiệu quả của thiết lập hình ảnh.
Quá trình oligome hóa protein huỳnh quang
Tất cả các protein huỳnh quang được phát hiện cho đến nay đều thể hiện ít nhất một mức độ hạn chế của cấu trúc bậc bốn, được minh họa bằng xu hướng yếu của protein huỳnh quang xanh Aequorea victoria bản địa và các dẫn xuất của nó là dimerize khi cố định ở nồng độ cao. Đối tượng thuê này được xác minh bằng quá trình giảm thiểu bắt buộc cần thiết cho khả năng hòa tan trong protein huỳnh quang phân lập từ pansies biển Renilla và mô típ tetramerization gần như phổ biến của protein huỳnh quang màu vàng, cam và đỏ tự nhiên được phân lập trong san hô rạn san hô và hải quỳ. Quá trình oligome hóa có thể là một vấn đề quan trọng đối với nhiều ứng dụng trong sinh học tế bào, đặc biệt trong trường hợp protein huỳnh quang được hợp nhất với protein chủ được nhắm mục tiêu tại một vị trí cụ thể dưới tế bào. Sau khi được biểu hiện, sự hình thành các dime và oligome bậc cao do phần protein huỳnh quang của chimera tạo ra có thể tạo ra sự định vị không điển hình, phá vỡ chức năng bình thường, cản trở các tầng tín hiệu hoặc hạn chế sản phẩm nhiệt hạch kết tụ trong một cơ quan cụ thể hoặc tế bào chất. Hiệu ứng này đặc biệt rõ rệt khi protein huỳnh quang được hợp nhất với các đối tác như Actin, tubulin, connexin hoặc histone, những chất này tham gia vào quá trình hình thành oligome tự nhiên. Các sản phẩm dung hợp với protein chỉ hình thành các dimer yếu (trên thực tế, hầu hết các biến thể Aequorea victoria GFP) có thể không thể hiện sự tập hợp hoặc nhắm mục tiêu không phù hợp, miễn là nồng độ cục bộ vẫn ở mức thấp. Tuy nhiên, khi các protein huỳnh quang dimeric được nhắm mục tiêu đến các ngăn tế bào cụ thể, chẳng hạn như màng sinh chất, thì trong một số trường hợp, nồng độ protein cục bộ có thể trở nên đủ cao để cho phép quá trình dimer hóa. Đây là mối quan tâm đặc biệt khi tiến hành các thí nghiệm truyền năng lượng cộng hưởng (FRET), có thể mang lại các tập dữ liệu phức tạp dễ bị xâm phạm bởi các tạo tác thu nhỏ.
Phương pháp cơ bản để khắc phục hiện tượng oligome hóa là sửa đổi trình tự axit amin của protein huỳnh quang để bao gồm các gốc làm gián đoạn liên kết giữa các phân tử, một quy trình có độ phức tạp khác nhau tùy thuộc vào bản chất và nguồn gốc của protein. Đối với nhiều biến thể Aequorea GFP, quá trình dime hóa có thể được giảm đáng kể hoặc loại bỏ hoàn toàn bằng cách thay thế chuỗi bên axit amin kỵ nước trong giao diện mờ hơn bằng các gốc tích điện dương ở một số vị trí trình tự quan trọng. Ba đột biến thành công nhất, theo thứ tự hiệu quả tăng dần, là F223R , L221K và A206K , trong đó các axit amin không phân cực phenylalanine, leucine và alanine được thay thế bằng họ hàng ưa nước của chúng là arginine hoặc lysine. Trong trường hợp nghi ngờ có mối liên hệ phân tử chặt chẽ liên quan đến protein tổng hợp và khi nghiên cứu các tương tác FRET định lượng, thì nên chuyển đổi các biến thể Aequorea GFP (ECFP, EGFP, EYFP) thành đơn phân bằng cách sử dụng một trong những đột biến điểm này.
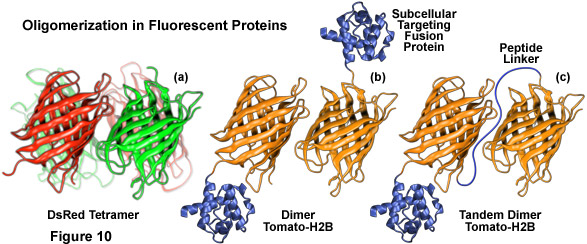
Việc tạo ra các monome protein huỳnh quang từ rạn san hô tetrameric và protein hải quỳ thường khó khăn hơn nhiều. Ví dụ, ngay cả ở nồng độ cực thấp, protein huỳnh quang DsRed là một tetramer bắt buộc không thể phân ly nếu không có sự biến tính không thể đảo ngược của các polypeptide. Trong đơn vị tetrameric, mỗi protein DsRed tương tác với hai protein lân cận, một thông qua bề mặt kỵ nước và một thông qua bề mặt ưa nước dẫn đến một tổ hợp phức tạp (xem Hình 10(a)). Các protein Anthozoa khác, chẳng hạn như các biến thể Zoanthus và eqFP611, có giao diện đơn giản hơn có thể dễ dàng phân tách thành các đơn phân. Các phương pháp tiếp cận thành công nhất được sử dụng cho đến nay để tạo ra các monome protein huỳnh quang với các loài Anthozoa liên quan đến quá trình gây đột biến định hướng tại chỗ lặp đi lặp lại để phá vỡ các giao diện tetrameric, thường bằng cách thay thế các axit amin ưa nước hoặc tích điện cho các gốc kỵ nước và trung tính. Bởi vì năng suất lượng tử phát xạ huỳnh quang giảm đáng kể thường đi kèm với những sửa đổi di truyền này, nên vòng đột biến ngẫu nhiên thứ hai thường là cần thiết để giải cứu huỳnh quang.
Một kỹ thuật khác liên quan đến việc tạo ra các vectơ chứa hai vùng mã hóa tuần tự được phân tách bằng một trình liên kết ngắn gồm các axit amin không đặc hiệu, được gọi là tandem dimers (Hình 10(c)), từ các protein tồn tại tự nhiên dưới dạng phức hợp dimeric và tetrameric. Sau khi biểu hiện, các protein huỳnh quang hợp nhất ưu tiên liên kết với nhau để tạo thành đơn vị dimeric nội phân tử hoạt động cơ bản như một monome, mặc dù có trọng lượng phân tử (và kích thước gấp đôi). Phương pháp này đã được áp dụng thành công với HcRed bằng cách kết hợp hai bản sao của trình tự DNA, được phân tách bằng một đoạn liên kết ngắn gồm bốn axit amin, với một số protein định vị dưới tế bào. Cấu trúc dimer song song cũng đã được phát triển với DsRed, dimeric Tomato (Hình 10(b)) và protein huỳnh quang đánh dấu quang học chuyển đổi quang học được gọi là Eos. Các cơ chế khác để giảm hiệu ứng tổng hợp và oligome hóa protein huỳnh quang bao gồm loại bỏ một số gốc cơ bản khỏi đầu N và đồng thời biểu hiện các protein được gắn thẻ huỳnh quang với lượng dư của một mình đối tác hợp nhất hoặc với một đột biến không phát huỳnh quang của protein đánh dấu. Bất kể cơ chế cụ thể nào được sử dụng để khắc phục quá trình oligome hóa protein huỳnh quang, điểm quan trọng nhất là kết quả thí nghiệm không bị ảnh hưởng bởi các tạo tác gây ra bởi sự tồn tại của cấu trúc bậc bốn.
Chimera tổng hợp protein huỳnh quang
Để điều chỉnh các protein huỳnh quang của sứa để sử dụng trong hệ thống động vật có vú, một số biến đổi axit amin cơ bản của protein huỳnh quang xanh đã được thực hiện và hiện được tìm thấy trong tất cả các biến thể được sử dụng phổ biến. Bước đầu tiên là tối ưu hóa sự phát triển huỳnh quang trong môi trường 37°C. Sự biểu biện của fluorophore khá hiệu quả ở 28°C, nhưng việc tăng nhiệt độ lên 37°C làm giảm đáng kể tốc độ trưởng thành và dẫn đến giảm huỳnh quang tổng thể. Đột biến của dư lượng phenylalanine ở vị trí 64 thành leucine ( F64L) dẫn đến biểu hiện huỳnh quang được cải thiện ở 37° C, ít nhất tương đương với kết quả quan sát được ở 28°C. Đột biến này hiện diện ở các loại protein huỳnh quang phổ biến nhất có nguồn gốc từ từ Aequorea victoria, nhưng không phải là đột biến duy nhất cải thiện khả năng gấp nếp ở 37° C, như các biến thể khác đã được phát hiện.
Ngoài sự cải thiện về sự trưởng thành của nhiễm sắc thể ở 37° C, việc tối ưu hóa việc sử dụng codon để biểu hiện ở động vật có vú cũng đã cải thiện độ sáng tổng thể của các dẫn xuất protein huỳnh quang màu xanh lá cây khi được biểu hiện trong tế bào động vật có vú. Tổng cộng, hơn 190 đột biến thầm lặng đã được đưa vào trình tự mã hóa để tăng cường biểu hiện trong các mô của con người. Vị trí bắt đầu dịch mã Kozak (chứa trình tự nucleotide A/GCCAT) cũng được giới thiệu bằng cách chèn valine làm axit amin thứ hai. Những điều này, cùng với nhiều cải tiến khác, đã tạo ra một loạt đầu dò huỳnh quang rất hữu ích để chụp ảnh tế bào sống của tế bào động vật có vú và phổ biến cho tất cả các biến thể huỳnh quang hiện đang được sử dụng có nguồn gốc từ protein sứa ban đầu.
Các thông số quan trọng liên quan đến việc thiết kế các sản phẩm phản ứng tổng hợp protein huỳnh quang bao gồm vị trí trình tự mã hóa protein huỳnh quang trong thể khảm, việc sử dụng hợp lý các trình tự liên kết axit amin làm khoảng cách giữa protein huỳnh quang và sản phẩm tổng hợp, đặc tính của trình tự khởi đầu và cơ chế kiểm tra độ trung thực của sản phẩm cuối cùng. Nói chung, hầu hết các phản ứng tổng hợp được thiết kế để định vị dưới tế bào đều đặt chuỗi protein huỳnh quang ở đầu N hoặc C của protein mục tiêu (mặc dù các phản ứng tổng hợp với protein huỳnh quang hoán vị vòng tròn đang trở nên phổ biến hơn). Trước tiên, các nhà điều tra nên kiểm tra dữ liệu về cấu trúc và chức năng (nếu có) để xác định vị trí thích hợp nhất cho protein huỳnh quang. Ví dụ, trong quá trình dung hợp với một protein phải tương tác với một đối tác gần một đầu cuối, đầu đối diện của protein sẽ là nơi tốt nhất để lưu trữ protein huỳnh quang. Trong nhiều trường hợp, các sản phẩm tổng hợp tương tự đã thành công với các protein liên quan hoặc ở các loài khác có thể được sử dụng làm hướng dẫn thiết kế các thể khảm mới. Tuy nhiên, khi thiếu dữ liệu trước đó, người điều tra chỉ còn lại phỏng đoán theo kinh nghiệm về vị trí lý tưởng nhất cho protein huỳnh quang và thường phải tạo ra các sản phẩm nhiệt hạch ở cả hai đầu.
Thay vì kết hợp trực tiếp chuỗi protein huỳnh quang với chuỗi protein, một đoạn ngắn axit amin không có chức năng thường được thêm vào, vừa là sự thuận tiện trong kỹ thuật nhân bản vừa là ống dẫn để tăng tính di động của phân tử tại điểm nối. Trong trường hợp lý tưởng, các trình tự liên kết nên bao gồm các axit amin có chuỗi bên đơn giản, chẳng hạn như glycine và alanine, có cấu trúc cho phép linh hoạt tối đa, mặc dù các gốc serine thường được xen kẽ thành các chuỗi dài hơn để tăng cường khả năng hòa tan của các miền polyglycine và polyalanine. Tuy nhiên, trên thực tế, các sản phẩm dung hợp thành công đã được tạo ra có chứa nhiều cấu hình đệm xen kẽ, từ không có axit amin liên kết đến 20 hoặc nhiều hơn. Thông thường, đặc biệt là khi sử dụng các vectơ nhân bản thương mại, việc sử dụng nhiều vị trí nhân bản (MCS) để cho phép chèn vào trong khung một cách thuận tiện sẽ dẫn đến các gốc axit amin tích điện hoặc kỵ nước được tích hợp vào sản phẩm nhiệt hạch. Trong phân tích cuối cùng, việc lựa chọn trình liên kết thường rất linh hoạt và nhiều cách kết hợp khác nhau cuối cùng có thể tạo ra các chimera hữu ích. Việc thêm một số axit amin bổ sung vào giữa protein huỳnh quang và mục tiêu vật chủ thường không ảnh hưởng đến sự biểu hiện hoặc định vị, mặc dù vẫn tồn tại các báo cáo về việc thiết kế trình liên kết là một khía cạnh quan trọng cho sự thành công của chimera.
Kết luận
Chiến lược phát triển protein huỳnh quang hiện nay tập trung vào việc tinh chỉnh bảng màu hiện tại của các biến thể từ xanh sang vàng có nguồn gốc từ loài sứa Aequorea victoria, đồng thời phát triển các protein huỳnh quang đơn phân phát ra các vùng màu cam đến đỏ xa của quang phổ ánh sáng khả kiến. Những nỗ lực mới nhất trong các biến thể của sứa đã mang lại kết quả là các đầu dò đơn phân mới và được cải tiến cho các vùng màu xanh lam, lục lam, lục lam và vàng, trong khi việc tìm kiếm không ngừng một loại protein huỳnh quang màu đỏ phát triển nhanh và đơn phân sáng đã mang lại nhiều ứng dụng để mở rộng bước sóng hơn. Những nỗ lực liên tục trong kỹ thuật tạo protein của các protein huỳnh quang hiện có, cùng với các công nghệ mới tiên tiến, sẽ tiếp tục mở rộng bảng màu và cuối cùng cung cấp các protein ở mọi lớp quang phổ biểu hiện qua các giai đoạn nhanh chóng, sáng và có thể quang hóa.
Nguồn: https://zeiss-campus.magnet.fsu.edu/articles/probes/fpintroduction.html
Công ty Minh Khang là nhà phân phối độc quyền thị trường miền Nam phân khúc kính hiển vi hãng Carl ZEISS.


 EN
EN