GIỚI THIỆU
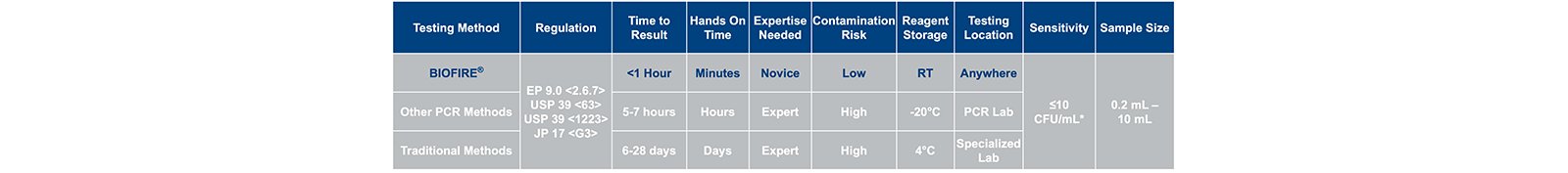
Các dược điển khác nhau, bao gồm USP, chỉ định thử nghiệm nhiễm khuẩn mycoplasma phải được thực hiện như một phần của thử nghiệm giải phóng sản phẩm được sản xuất với sự có mặt của tế bào nhân chuẩn (1).
Các phương pháp tổng hợp hiện tại yêu cầu ≥28 ngày để tạo ra kết quả, tạo ra sự chậm trễ trong việc phát hành sản phẩm cho các quy trình hạ nguồn. Các phương pháp xét nghiệm thay thế axit nucleic thông thường (NAT) có sẵn; Tuy nhiên, cho đến gần đây các phương pháp này cung cấp tốc độ (~ 5 giờ) nhưng không dễ sử dụng.
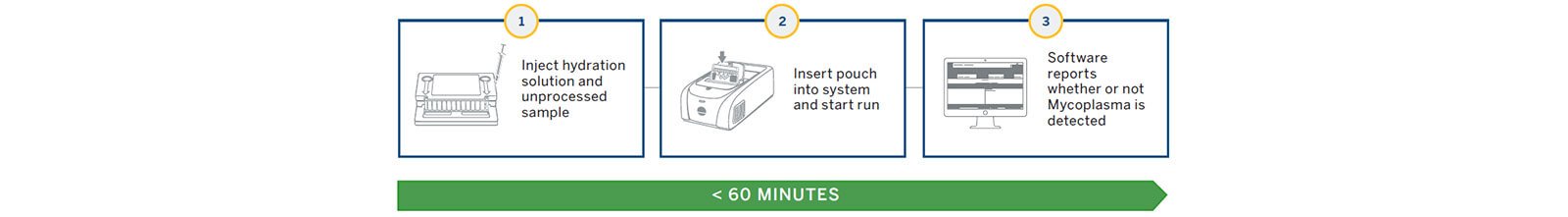
Hệ thống công nghiệp BIOFIRE® FILMARRAY® 2.0 sử dụng hệ thống FilmArray và thử nghiệm PCR thế hệ tiếp theo, trong đó tất cả các thành phần thuốc thử được chứa trong một túi kín để phát hiện >130 loài mycoplasma. Hệ thống cung cấp mẫu để phản hồi trong ~ 1 giờ mà không cần được đào tạo kỹ thuật , cung cấp các tùy chọn để đưa xét nghiệm mycoplasma trực tiếp đến sản xuất, nơi cần thử nghiệm quan trọng.
*10 mL protocol
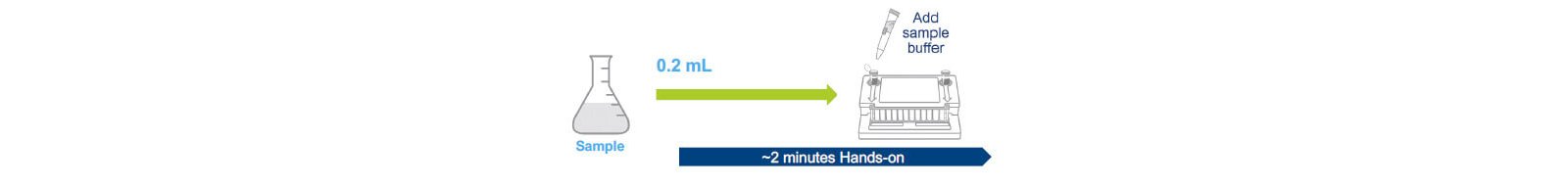
Như đã trình bày tại Hội nghị ảo Vi sinh dược phẩm PDA năm 2021, dữ liệu được tóm tắt trong Sách trắng là từ bốn nhà sản xuất sản xuất sinh học đã đánh giá hệ thống Công nghiệp BIOFIRE®FILMARRAY® 2.0 (2). Các mẫu được đánh giá với tối đa 9 loài mycoplasma tổng hợp với sự có mặt của kháng thể đơn dòng mật độ cao sản xuất tế bào buồng trứng chuột đồng Trung Quốc (CHO). Các nghiên cứu được thiết kế để đánh giá sự can thiệp của sản phẩm (tỷ lệ dương tính giả) và phát hiện (tỷ lệ âm tính giả) bao gồm mức độ phát hiện (LOD). Hai giao thức riêng biệt đã được đánh giá: một giao thức sử dụng 10 mL mẫu sản phẩm cung cấp độ nhạy để thử nghiệm phát hành và giao thức kiểm tra trực tiếp sử dụng mẫu sản phẩm 0,2 mL cho phép thử nghiệm kiểm soát trong quá trình trực tuyến.
GIÁ TRỊ CỦA XÉT NGHIỆM MYCOPLASMA NHANH CHÓNG, DỄ DÀNG
Một cách tiếp cận nhanh hơn, dễ dàng hơn để thử nghiệm mycoplasma có thể mang lại giá trị định lượng cho các nhà sản xuất sản xuất sinh học. Từ việc đơn giản hóa các yêu cầu đào tạo, đến giảm các cuộc điều tra liên quan đến lỗi của con người, đến việc cung cấp cảnh báo sớm về nhiễm khuẩn, xét nghiệm mycoplasma cực nhanh, cực kỳ dễ dàng có thể tiết kiệm thời gian và chi phí mang lại giá trị cho bất kỳ tổ chức sản xuất sinh học nào. Xét nghiệm mycoplasma BIOFIRE® có thể được thực hiện bởi bất kỳ ai, bất cứ nơi nào vào bất cứ lúc nào cho phép các nhà sản xuất thực hiện thử nghiệm chất lượng quan trọng ra khỏi phòng thí nghiệm và gần hơn với sản xuất để nhận ra những lợi ích sau:
• Yêu cầu đào tạo đơn giản hóa
• Yêu cầu chuyên môn thấp hơn
• Kết quả khách quan
• Ít rủi ro lỗi của con người / Cải thiện tính toàn vẹn dữ liệu
• Không yêu cầu xét nghiệm PCR
• Thời gian 1 giờ để có kết quả mang lại sự linh hoạt trong việc lập kế hoạch kiểm tra
• Cung cấp cảnh báo sớm về ô nhiễm và giảm chi phí không chất lượng

HỆ THỐNG CÔNG NGHIỆP BIOFIRE FILMARRAY 2.0
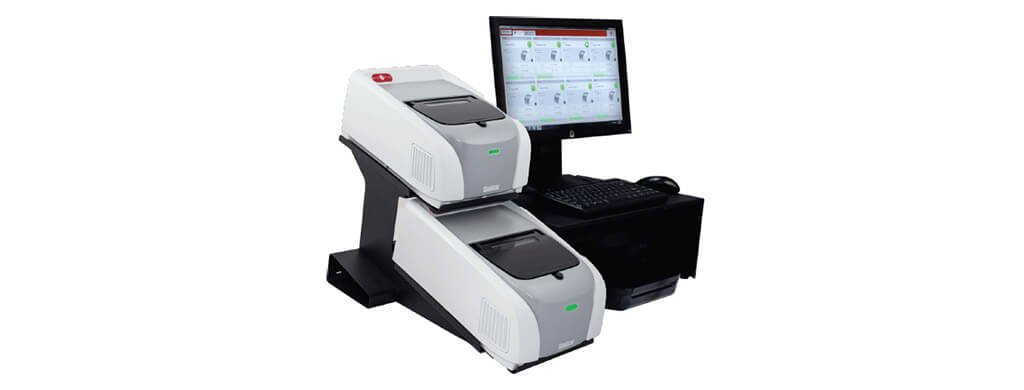
Hệ thống sử dụng thiết bị công nghiệp FILMARRAY® 2.0 và xét nghiệm PCR thế hệ tiếp theo trong túi kín để phát hiện ra vi khuẩn mycoplasma (Hình 1 và 2). Túi BIOFIRE® Mycoplasma dùng một lần chứa tất cả các thuốc thử cần thiết để ly giải tế bào tự động, tinh chế axit nucleic, phiên mã ngược, PCR lồng nhau giai đoạn thứ nhất và thứ hai và phát hiện phân tích để phân lập, khuếch đại và phát hiện hơn 130 loài mycoplasma khác nhau (Hình 2).
Một số điều khiển được tích hợp vào túi để đảm bảo chất lượng của kết quả bao gồm kiểm soát toàn bộ quy trình, kiểm soát phiên mã ngược và kiểm soát PCR I và PCR II. Dụng cụ và phần mềm xử lý túi với kết quả trong vòng chưa đầy một giờ.
Phần mềm Công nghiệp FILMARRAY® 2.0 (21 CFR Phần 11 đã sẵn sàng tuân thủ) thực hiện tất cả các phân tích tổng hợp phức tạp và cung cấp kết quả hiện diện / vắng mặt dưới dạng “Phát hiện ra Mycoplasma” hoặc “Không phát hiện Mycoplasma”.
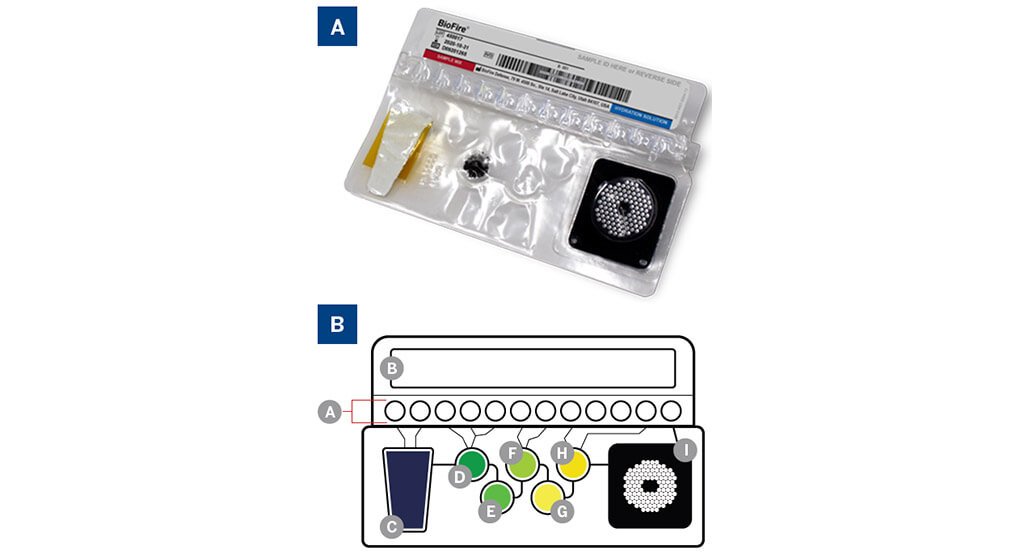
A. Túi Mycoplasma BIOFIRE®.
B. Sơ đồ túi: (A) Lắp thuốc thử đông khô; (B) Pít tông cung cấp thuốc thử cho bọt khí; (C) Ly giải mẫu và thu thập hạt; (d) Rửa; (E) Vỉ thu gom hạt từ tính; (f) Sự pha trộn; (G) Vỉ PCR bên ngoài ghép kênh; (H) Vỉ pha loãng; (I) Mảng PCR lồng nhau bên trong
PROTOCOL
Hai protocol riêng biệt đã được thiết kế để phát hiện nhiễm khuẩn mycoplasma(3). Chúng bao gồm thử nghiệm trực tiếp 0,2 mL có thể được sử dụng để kiểm tra đối chứng trong quá trình với LOD đã được xác nhận là ~ ≤30 CFU / mL và thử nghiệm giải phóng 10 mL tập trung mẫu bằng cách ly tâm và có LOD được xác nhận là ≤ 10 CFU / mL.
Các protocol này được tuân theo bởi các nhà đánh giá ngoại trừ Evaluator B đi chệch khỏi các khuyến nghị của nhà sản xuất với thời gian và lực ly tâm tùy chỉnh. Sau khi xử lý trước mẫu, các mẫu sau đó được nạp vào một túi được chuẩn bị đầy đủ và hidrat hoá và chạy trên thiết bị Công nghiệp FILMARRAY® 2.0.
Minh Khang là nhà phân phối độc quyền giải pháp Dược phẩm hãng BioMérieux (Pháp).



 EN
EN