Trong AppNote này, Beckman Coulter trình bày cách sử dụng Lò phản ứng vi sinh BioLector XT để nuôi cấy vi sinh vật trong môi trường có nhiều oxy. Không khí giàu oxy lên đến 50% O2 được sử dụng và kết quả được so sánh với các thí nghiệm với khí quyển thông thường. Mô-đun vi lỏng của hệ thống BioLector được sử dụng để cung cấp chính xác chất nền theo vòng lặp mở và vòng lặp kín với nhiều chiến lược cung cấp khác nhau, đồng thời cung cấp khả năng kiểm soát độ pH của môi trường nuôi cấy trong suốt quá trình thí nghiệm. Sự khác biệt giữa các thí nghiệm được cung cấp khí bằng không khí thông thường và các thí nghiệm có hàm lượng oxy tăng cao minh họa cho các khả năng và lợi thế mà Lò phản ứng vi sinh BioLector XT mang lại bằng cách cho phép nuôi cấy trong điều kiện nồng độ oxy cao.
Giới thiệu
Để tối ưu hóa năng suất sản phẩm, các chủng sản xuất được thiết kế về mặt di truyền và chuyển hóa và các quy trình lên men được tối ưu hóa và mở rộng đến giới hạn kỹ thuật để đạt được năng suất không gian-thời gian cao nhất.
Trong số những yếu tố khác, những cân nhắc chính là độ hòa tan, tính không ổn định và tính dễ bay hơi của các chất nền và sản phẩm rắn và khí. Hơn nữa, hầu hết các thành phần môi trường đều trở nên ức chế đối với các hệ thống sinh học ở nồng độ cao. Do đó, trong một môi trường xác định có chứa nồng độ chất dinh dưỡng tối đa, không gây ức chế, Escherichia coli chỉ có thể được nuôi cấy theo mẻ đến mật độ tế bào ~15 gcdw/L. Do đó, cần có các chiến lược nuôi cấy và môi trường được thiết kế tốt để đáp ứng nhu cầu ngày càng tăng về năng lượng, carbon, nitơ và các chất dinh dưỡng khác trong khi ngăn ngừa sự ức chế chất nền không mong muốn.
Một động lực mạnh mẽ khác cho nuôi cấy theo mẻ là cái gọi là quá trình chuyển hóa tràn glucose. Ngay cả trong điều kiện hiếu khí, các sinh vật phát triển nhanh vẫn giải phóng các sản phẩm lên men; ví dụ, Escherichia coli tạo ra axetat, Bacillus subtilis propionate, Lactococcus lactis lactate và Saccharomyces cerevisiae ethanol. Việc hình thành các sản phẩm phụ này có thể gây lãng phí vì hô hấp dẫn đến sản lượng ATP cao hơn quá trình lên men và có khả năng ức chế một số đặc tính sinh lý của chính quá trình nuôi cấy. Tuy nhiên, hiện tượng này được quan sát thấy ở khắp mọi nơi trong nhiều sinh vật khác nhau, bao gồm vi khuẩn, nấm và tế bào động vật có vú, dẫn đến một số lý thuyết giải thích quá trình hô hấp và lên men song song, bao gồm ức chế chu trình TCA, phân bổ proteome hiệu quả hơn, và sự giới hạn không gian bên trong màng cho chuỗi vận chuyển điện tử.
Tuy nhiên, đối với nhiều ứng dụng, các chất chuyển hóa tràn này được coi là sản phẩm phụ không mong muốn, vì vậy nuôi cấy vi sinh vật thường được thực hiện trong điều kiện nuôi dưỡng mà các chất dinh dưỡng cụ thể – thường là glucose – bị hạn chế. Bằng cách làm như vậy, nhiều vi sinh vật đã được nuôi cấy đến mật độ tế bào cao hơn 100 gcdw/L, nhưng một số vi sinh vật không phù hợp với nuôi cấy mật độ tế bào cao (HCDC) và chỉ có khả năng đạt nồng độ chỉ vài gam trên một lít trọng lượng khô của tế bào.
Nuôi cấy hiếu khí thường phụ thuộc vào tốc độ truyền oxy cao để ngăn ngừa bất kỳ hạn chế nào do nguồn cung cấp oxy không đủ. Ví dụ, để đạt được mật độ tế bào E. coli là 145 gcdw/L, Horn và cộng sự đã duy trì oxy hòa tan trên 20% độ bão hòa không khí (as) trong suốt quá trình nuôi cấy. Để đạt được và duy trì đầy đủ mức oxy mong muốn trong quá trình HCDC, có thể cần bổ sung hoặc thay thế nguồn cung cấp không khí bằng oxy nguyên chất. Nồng độ oxy hòa tan dưới mức tới hạn gây ra tốc độ tăng trưởng cụ thể giảm, chuyển dịch quá trình trao đổi chất và hình thành các chất chuyển hóa không mong muốn như axetat, lactat và etanol đã đề cập ở trên, dẫn đến mật độ tế bào và năng suất thể tích thấp hơn ở nhiều sinh vật khác nhau. Tuy nhiên, việc cung cấp khí với nồng độ oxy tăng cũng có thể thúc đẩy rò rỉ nhiều hơn các loài oxy phản ứng (ROS).
Trong cả nghiên cứu và công nghiệp, nồng độ oxy hòa tan (DO) của một nền văn hóa cũng đã được sử dụng như một yếu tố kích hoạt để vận hành hồ sơ thức ăn. Các bộ điều khiển vòng kín này được sử dụng để ví dụ, điều chỉnh tỷ lệ cho ăn dựa trên giá trị pH hoặc DO trực tuyến. Các biện pháp kiểm soát phản hồi dựa trên giá trị DO đã được báo cáo cho nhiều loại sinh vật và sản phẩm khác nhau. Chúng thường dựa vào việc kích hoạt việc cho ăn thêm chất nền dựa trên tín hiệu DO tăng nhanh của nền văn hóa do thiếu chất nền.
Một sinh vật gần đây được quan tâm là Vibrio natriegens (còn được gọi là Pseudomonas natriegens hoặc Beneckea natriegens). Đây là sinh vật phát triển nhanh nhất, không gây bệnh được biết đến cho đến nay với thời gian thế hệ được báo cáo chỉ là 9,4 phút trong điều kiện tối ưu. Tương tự như E. coli, đây là vi khuẩn Gram âm, kỵ khí tùy ý, nhưng có tốc độ hấp thụ glucose và oxy cao hơn để hỗ trợ các đặc tính tăng trưởng nhanh của nó. Nó có thể phát triển trên nhiều loại chất nền khác nhau và được báo cáo là tiết ra axetat như một chất chuyển hóa tràn trong quá trình nuôi cấy hiếu khí trên glucose.
Tốc độ tăng trưởng nhanh khiến V. natriegens trở thành một khung nền tiềm năng cho nhiều ứng dụng công nghệ sinh học và quy trình nhân bản, và kể từ năm 2016, nó có thể được sử dụng để thao tác di truyền. Hiện nay, một bộ sưu tập các công cụ di truyền đã được thiết lập và áp dụng để tạo ra các chủng nền tảng và sản xuất vượt trội bằng kỹ thuật di truyền, nhưng kiến thức cơ bản hơn nữa là điều cần thiết cho các chiến lược kỹ thuật chuyển hóa trong tương lai.
Năm 2021, HCDC fed-batch đầu tiên với V. natriegens đã được báo cáo với năng suất sinh khối lên tới 55 gcdw/L. Trong quá trình nuôi cấy fed-batch, tỷ lệ hấp thụ oxy lên tới 500 mmol * L-1 * h-1 đã được báo cáo, đòi hỏi tỷ lệ sục khí lên tới 2 vvm với không khí giàu oxy chứa 60% oxy để duy trì DO ở mức 40% như trong quá trình nuôi cấy.
Lò phản ứng vi sinh BioLector XT là một hệ thống mạnh mẽ để tiếp tục nghiên cứu và tối ưu hóa các chiến lược và quy trình nuôi cấy yêu cầu lượng oxy cao này, vì nó có khả năng nuôi cấy theo mẻ song song ở quy mô µL, kiểm soát chính xác tốc độ nạp liệu trên mỗi giếng. Hơn nữa, nắp thoát khí linh hoạt giúp kiểm soát tốt hơn thành phần khí hóa và tốc độ dòng chảy. Không khí giàu oxy lên đến 100% oxy có thể được sử dụng để cung cấp đủ oxy cho các nuôi cấy để cho phép tốc độ truyền oxy cao, đặc biệt là khi sử dụng các đĩa vi mô FlowerPlate.
Phương pháp
Vibrio natriogen
Vibrio natriegens23 Axenic được lấy từ DSMZ-German Collection of Microorganisms and Cell Cultures GmbH từ Leibniz Institutes (DSMZ Number 759). Ngoài ra, Escherichia coli BL 21(DE3) đã được sử dụng.
Môi trường nuôi cấy và dung dịch cung cấp
Vibrio natriegens được nuôi cấy trong công thức thích hợp của môi trường tối thiểu VN1, với giá trị pH được thiết lập là 7,5. Môi trường chứa (L-1): 42 g axit 3-(N-morpholino) propanesulfonic (MOPS), 5 g (NH4)2SO4, 15 g NaCl, 1 g KH2PO4, 1 g K2HPO4, 0,25 g MgSO4, 0,01 g CaCl2, 16,4 mg FeSO4 *7 H2O, 10 mg MnSO4 * H20, 0,3 mg CuSO4 * 5 H20, 1 mg ZnSO4 * 7H2O, 0,02 mg NiCl2 * 6 H2O và được bổ sung dung dịch glucose đã hấp tiệt trùng đến nồng độ cuối cùng là 10 g * L-1 trước khi cấy. Công thức này cũng được sử dụng để ủ các mẫu nuôi cấy trước trong bình lắc.
Đối với nuôi cấy theo mẻ, một công thức dung dịch thức ăn thích hợp cho phép sử dụng HCDC19 bao gồm (L-1): 500 g glucose, 20 g (NH4)2SO4, 15 g NaCl, 20 g KH2PO4, 20 g K2HPO4, 5 g MgSO4, 0,01 g CaCl2, 16,4 mg FeSO4 * 7 H2O, 10 mg MnSO4 * H20, 0,3 mg CuSO4 * 5 H20, 1 mg ZnSO4 * 7H2O và 0,02 mg NiCl2 * 6 H2O.
E. coli được nuôi cấy trong môi trường Wilms-MOPS chứa (L-1): 10,5 g axit 3-(N-morpholino) propanesulfonic (MOPS, C7H15NO4S), 3 g K2HPO4, 5 g (NH4)2SO4, 0,5 g NH4Cl, 2 g Na2SO4, 0,5 g MgSO4 * 7 H2O, 0,01 g thiamine hydrochloride (C12H17ClN4OS * HCl), 0,54 mg ZnSO4 * 7 H2O, 0,31 mg CuSO4, 0,3 mg MnSO4 * H20, 41,76 mg FeCl3 * 6 H2O, 33,39 mg Titriplex III (C10H14N2Na2O8 * 2 H2O), 0,54 mg CoCl2 * 6 H2O, 1,98 mg CaCl2 * 2 H2O và 20 g * L-1 glucose. Đối với nuôi cấy theo mẻ, dung dịch thức ăn được sử dụng có chứa 417 g * L-1 glucose, 42 g * L-1 (NH4)2SO4 và 4,2 g * L-1 NH4Cl.
Cả nuôi cấy V. natriegens và E. coli đều được thiết kế với khả năng kiểm soát pH một chiều nhờ 5 mol * L-1 NaOH, cung cấp cho các nuôi cấy từ giếng chứa của hàng MTP B. Hàng A được sử dụng cho các dung dịch nuôi cấy theo mẻ giàu glucose (hình học MTP vi lưu có thể được tìm thấy trong Hình 2.
Nuôi cấy trước trong bình lắc
Các thí nghiệm chính trong lò phản ứng vi sinh BioLector XT được gieo từ các mẫu nuôi cấy trước được ủ ở 37°C và lắc ở tốc độ 280 vòng/phút (máy lắc quỹ đạo 25 mm) trong vài giờ. Các mẫu tiền nuôi cấy của E. coli được nuôi trong Wilms-MOPS như mô tả ở trên, ngoại trừ việc có nồng độ MOPS tăng lên là 42 g * L-1. Đối với Vibrio natriegens, thành phần của môi trường VN không thay đổi. Đối với cả hai, 15 mL môi trường được cấy từ các mẫu nuôi cấy đông lạnh mới rã đông và sau đó được nuôi cấy trong bình lắc 250 mL với nắp bông
Mẫu tiền nuôi cấy E. coli và V. natriegens được ủ trong 4 và 3 giờ tương ứng để đảm bảo tăng trưởng theo cấp số nhân. Sau đó, OD600 của các nuôi cấy được xác định để tính toán thể tích cần thiết cho quá trình tiêm chủng.
Nuôi cấy trong hệ thống BioLector XT
Các thí nghiệm được thực hiện trên lò phản ứng vi sinh BioLector XT, được trang bị mô-đun vi lỏng. Nuôi cấy được tiến hành trong các đĩa vi mô FlowerPlate Gen2 Microfluidic, được niêm phong bằng lá niêm phong thấm khí phù hợp cho các thí nghiệm vi lỏng. Để đánh giá thời gian thực các thông số nuôi cấy chính, các mô-đun lọc sau đã được lắp đặt: Sinh khối (ID: 501), pH (HP8, ID: 502) và DO (PSt3, ID: 503). Nắp khí hóa của hệ thống BioLector XT cải tiến cho phép kiểm soát chính xác thành phần khí hóa – từ 0 đến 100% oxy hoặc lên đến 12% carbon dioxide – và lưu lượng, nhờ đó đĩa vi mô FlowerPlate đảm bảo tốc độ truyền (oxy) tối đa. Ở đây, các thí nghiệm được tiến hành bằng cách sử dụng không khí bình thường (21% oxy) và với nồng độ oxy tăng lên đến 50%, cả hai đều ở lưu lượng cố định là 50 mL * phút-1. Đối với các thí nghiệm với nồng độ oxy tăng lên, chế độ khí hóa điều chỉnh tăng O2 được sử dụng và hàm lượng oxy được tăng dần trong giờ đầu tiên sau đó được giữ không đổi ở mức 50%.
 Đối với V. natriegens, OD600 ban đầu là 0,1 được thiết lập bằng cách tiêm chủng từ tiền nuôi cấy. E. coli được gieo ở OD600 = 0,5. Tất cả các giếng nuôi cấy (hàng C đến F) đều có thể tích ban đầu là 800 µL và đĩa vi mô FlowerPlate được sử dụng có thể tích nuôi cấy tối đa là 1400 µL ở tần số lắc là 1200 vòng/phút. Thể tích tối đa cho các giếng chứa (hàng A và B) là 1800 µL và được đổ đầy tương ứng cho nguồn glucose ở hàng A. Ở hàng B, 1200 µL nguồn cơ sở đã được thêm vào. Không có giếng chứa nào cạn trong quá trình nuôi cấy được trình bày trong ghi chú ứng dụng này.
Đối với V. natriegens, OD600 ban đầu là 0,1 được thiết lập bằng cách tiêm chủng từ tiền nuôi cấy. E. coli được gieo ở OD600 = 0,5. Tất cả các giếng nuôi cấy (hàng C đến F) đều có thể tích ban đầu là 800 µL và đĩa vi mô FlowerPlate được sử dụng có thể tích nuôi cấy tối đa là 1400 µL ở tần số lắc là 1200 vòng/phút. Thể tích tối đa cho các giếng chứa (hàng A và B) là 1800 µL và được đổ đầy tương ứng cho nguồn glucose ở hàng A. Ở hàng B, 1200 µL nguồn cơ sở đã được thêm vào. Không có giếng chứa nào cạn trong quá trình nuôi cấy được trình bày trong ghi chú ứng dụng này.

Điểm đặt pH cho tất cả các lần nuôi cấy E. coli được đặt ở mức 7,2 (phần mềm BioLection được lập trình sẵn cài đặt PI: Môi trường) và bộ điều khiển pH một chiều được kích hoạt sau 1 giờ để hệ thống có thời gian ổn định ngay sau khi bắt đầu thí nghiệm. Điểm đặt cho các lần nuôi cấy với V. natriegens là 7,5. Do hàm lượng muối cao trong môi trường tối thiểu VN nên cần sử dụng bộ dữ liệu hiệu chuẩn pH tùy chỉnh. Để phù hợp hơn với đặc điểm tăng trưởng nhanh của V. natriegens, các cài đặt PI tùy chỉnh đã được thiết lập: Thể tích tối thiểu: 0,1 µL * chu kỳ-1, Thể tích tối đa: 15 µL * chu kỳ-1, Dải P: 0,2, Bộ tích hợp: 1, Thể tích bắt đầu: 0,2 µL, Dải chết: 0,05,26
Tất cả các nguồn cấp glucose được bắt đầu sau 4 giờ đối với E. coli và sau 3,5 giờ đối với V. natriegens. Dựa trên các đợt nuôi cấy (trước đó) trong những hoàn cảnh tương tự, glucose bổ sung vào môi trường trước khi tiêm chủng (gần như) sẽ cạn kiệt tại thời điểm này. Hoạt hóa được kích hoạt theo thời gian cũng cho phép khả năng tái tạo và khả năng so sánh tốt giữa các thí nghiệm với khí không khí và khí oxy tăng cường.
Một số hồ sơ và chiến lược cung cấp đã được thiết lập trên toàn bộ đĩa vi mô (MTP): Đối với một số giếng, không có quá trình cung cấp glucose nào được kích hoạt để đạt được quá trình nuôi cấy theo mẻ được kiểm soát pH. Đối với quá trình nuôi cấy theo mẻ, cả hồ sơ cung cấp liên tục và hồ sơ cung câos kích hoạt bằng tín hiệu đều được thiết kế. Các chiến lược tốc độ cung cấp liên tục có thể được quản lý chính xác trong phần mềm BioLection bằng công thức sau, trong đó các tham số A, B, C và D đều có thể được chọn độc lập:
dV / dt = A+B*t+C*e D*t
Đối với ghi chú ứng dụng này, chỉ áp dụng tỷ lệ cung cấp không đổi và tăng tuyến tính, do đó đối với tham số C và D, giá trị 0 được sử dụng cho tất cả các chiến lược. Các giá trị cài đặt cho A và B có thể được tìm thấy trong Bảng 1. Nguồn cấp tín hiệu kích hoạt được thiết kế để bơm 4 µL dung dịch cho ăn glucose vào quá trình nuôi cấy mỗi khi nồng độ oxy hòa tan được đo cao hơn 6%. Để bù cho lượng cung cấp glucose hoặc bazơ không bằng nhau được thêm vào các quá trình nuôi cấy, tất cả các phép đo sinh khối trực tuyến đều được hiệu chỉnh theo thể tích nuôi cấy thực tế của chúng.
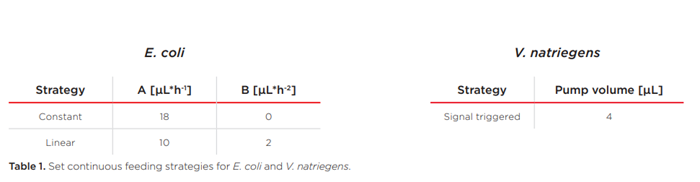
Kết quả
Cải thiện hiệu suất E. coli với không khí giàu oxy
Việc so sánh giữa nuôi cấy E. coli theo mẻ với nuôi cấy thông thường và nuôi cấy không khí giàu oxy cho thấy phạm vi hoạt động rộng hơn mà chế độ khí hóa O2-up bổ sung vào lò phản ứng vi sinh và cho thấy cách thức nó ảnh hưởng đến quá trình nuôi cấy. Kết quả nuôi cấy E. coli với tốc độ nuôi cấy liên tục, không đổi được thể hiện trong Hình 3.
Đường biểu diễn của oxy hòa tan trong biểu đồ bên trái ở Hình 3 cho thấy rõ tác động của việc cung cấp khí với oxy giàu lên quá trình nuôi cấy. Nồng độ oxy tăng dần trong khí đầu vào dẫn đến tín hiệu DO tăng dần trong giờ đầu tiên. Sau đó, DO bắt đầu giảm trong tất cả các môi trường nuôi cấy khi E. coli phát triển hiếu khí khi có glucose. Sau 4 giờ, quá trình cung cấp glucose bắt đầu và không lâu sau đó, quá trình cung cấp khí với không khí thông thường không còn cung cấp đủ oxy cho các môi trường nuôi cấy nữa. Điều này dẫn đến tình trạng hạn chế oxy trong suốt quá trình thí nghiệm còn lại. Tuy nhiên, với việc điều chỉnh tăng O2, các môi trường nuôi cấy được cung cấp đủ oxy để phát triển theo cấp số nhân trong 5,75 giờ đầu tiên. Sau giai đoạn tăng trưởng theo cấp số nhân kéo dài so với nuôi cấy bằng khí, người ta quan sát thấy giai đoạn tăng trưởng tuyến tính. Ở đây, rất có thể, tốc độ cung cấp glucose không đổi không còn đủ để cho phép tăng trưởng theo cấp số nhân nữa; và môi trường nuôi cấy phát triển trong điều kiện hạn chế glucose trong suốt thời gian còn lại của thí nghiệm. Tuy nhiên, nồng độ sinh khối thu được cao hơn so với nuôi cấy bằng khí (và hạn chế oxy).
Biểu đồ bên phải cho thấy độ pH và tổng thể tích NaOH được sử dụng để kiểm soát độ pH trong các thí nghiệm này. Trong 4 giờ đầu tiên, các quá trình có thể so sánh được, nhưng tác động của hạn chế oxy được quan sát thấy khi giai đoạn nuôi cấy mẻ được bắt đầu. Nuôi cấy thiếu oxy đòi hỏi lượng kiềm cao hơn, tuy nhiên độ pH giảm khoảng 0,1 dưới điểm đặt sau khi xảy ra hạn chế oxy. Rất có thể, quá trình trao đổi chất tràn (kỵ khí) dẫn đến sản xuất nhiều chất chuyển hóa thứ cấp hơn – như axetat – so với nuôi cấy không hạn chế oxy làm axit hóa nuôi cấy.
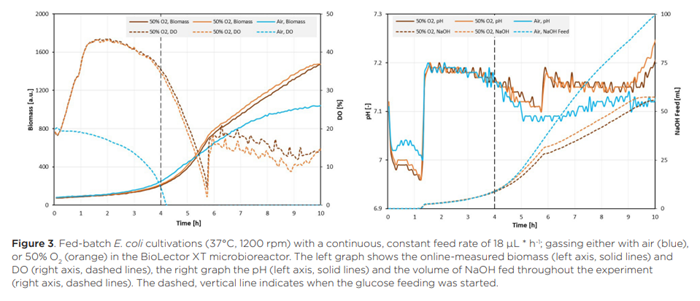
Đối với các phương pháp nuôi cấy E. coli với chế độ cho ăn tuyến tính, người ta quan sát thấy kết quả rất giống nhau (Hình 4) như khi nuôi cấy với tốc độ cho ăn không đổi.
Một lần nữa, các môi trường cung cấp được cung cấp khí bằng không khí trong khí quyển trở nên hạn chế oxy ngay sau khi bắt đầu cung cấp glucose trong khi việc cung cấp khí bằng lượng lớn oxy ngăn chặn điều này xảy ra. Tuy nhiên, so với Hình 3, tín hiệu DO trong các môi trường nuôi cấy được cung cấp khí làm giàu oxy không giảm xuống thấp như vậy và đạt đến mức tối thiểu cục bộ sớm hơn một chút (sau khoảng 5,5 giờ). Điều này có thể được giải thích bằng sự khác biệt trong hồ sơ cung cấp giữa các quá trình nuôi cấy này. 4 giờ đầu tiên sau khi bắt đầu cung cấp, hồ sơ cung cấp liên tục có tốc độ cao hơn hồ sơ tuyến tính, điều này kéo dài giai đoạn tăng trưởng theo cấp số nhân trước khi khả năng cung cấp glucose trở thành yếu tố hạn chế. Giống như trong các giếng được cung cấp liên tục, sự phát triển hạn chế oxy trên glucose dẫn đến lượng NaOH cao hơn được cung cấp cho môi trường nuôi cấy, điều này chứng minh sự khác biệt về chuyển hóa xảy ra giữa sự phát triển hiếu khí và kỵ khí của E. coli, và do đó, tác động của việc cung cấp khí bằng lượng lớn oxy lên quá trình nuôi cấy.
Chiến lược cung cấp kích hoạt tín hiệu với V. natriegens
Đối với nuôi cấy Vibrio natriegens, một chiến lược cung cấp nhằm đạt được tốc độ tiêu thụ glucose cao mà không buộc nuôi cấy vào tình trạng hạn chế oxy đã được thử nghiệm: cung cấp glucose được kích hoạt bằng tín hiệu dựa trên lượng oxy có sẵn trong môi trường nuôi cấy. Điều này – khi được thiết lập chính xác – sẽ ngăn chặn tình trạng hạn chế oxy ở tốc độ cho ăn glucose (gần) tối đa. Để làm như vậy, bộ kích hoạt cung cấp glucose được đặt ở DO >6% và 4 µL dung dịch cung cấp glucose được thêm vào nuôi cấy cho mỗi lần cung cấp. Nuôi cấy được thực hiện với không khí và lượng lớn oxy, điều này được kỳ vọng sẽ nâng cao kết quả nuôi cấy vì việc cung cấp glucose được kích hoạt bởi lượng oxy có sẵn. Kết quả của những nuôi cấy này có thể được tìm thấy trong Hình 5.
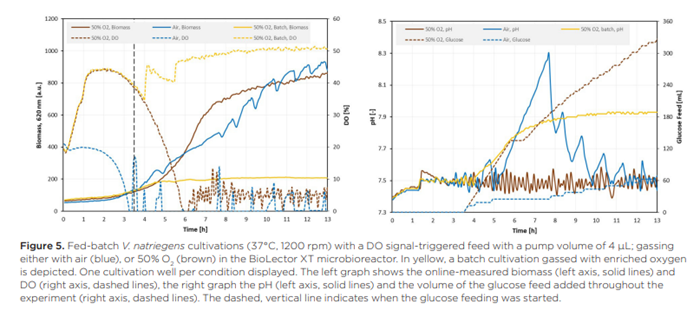
Biểu đồ trong Hình 5 cho thấy một quá trình nuôi cấy rõ ràng khác biệt khi sử dụng không khí giàu oxy. Trong chế độ mẻ ban đầu, các tế bào đã tiêu thụ đủ glucose để bị giới hạn oxy khi không có oxy bổ sung nào được áp dụng cho quá trình nuôi cấy. Sau bốn giờ, glucose ban đầu được sử dụng hết hoàn toàn, như có thể thấy từ việc tăng giá trị DO và pH trong dữ liệu nuôi cấy mẻ (dữ liệu màu vàng trong Hình 5). Chiến lược cung cấp glucose được kích hoạt sau 3,5 giờ và tại thời điểm đó, cả nuôi cấy không khí bình thường và nuôi cấy không khí giàu oxy đều có giá trị DO lớn hơn 6%, điều này kích hoạt việc bắt đầu cung cấp glucose ngay lập tức trong cả hai lần nuôi cấy. Do đó, trong khoảng ~ 15 phút đầu tiên, nguồn cấp dữ liệu giống hệt nhau cho cả hai điều kiện, nhưng với không khí thường xuyên, tín hiệu DO nhanh chóng giảm xuống dưới 6%, làm gián đoạn nguồn cấp dữ liệu glucose vì kích hoạt cung cấp dữ liệu không còn được đáp ứng nữa.
Đối với quá trình nuôi cấy với 50% oxy, hàm lượng oxy tăng lên giúp duy trì tín hiệu DO ở mức trên 6% trong khoảng 5,75 giờ. Việc kích hoạt nguồn cấp glucose sau 3,5 giờ kéo dài giai đoạn tăng trưởng theo cấp số nhân so với nuôi cấy theo mẻ và cuối cùng dẫn đến giới hạn oxy khoảng 6 giờ sau khi bắt đầu thí nghiệm. Việc cung cấp glucose được dừng lại cho đến khi giá trị DO lại vượt quá ngưỡng 6% sau 6,5 giờ. Điều này dẫn đến tốc độ tăng trưởng tuyến tính, có mối tương quan mạnh với tốc độ cung cấp glucose trong thời gian còn lại của thí nghiệm, trong thời gian đó, nguồn cấp glucose kích hoạt DO hoạt động như mong muốn: Bất cứ khi nào tín hiệu DO thay thế ngưỡng kích hoạt, glucose sẽ được thêm vào môi trường nuôi cấy, dẫn đến tín hiệu DO giảm do quá trình chuyển hóa hiếu khí trên glucose. Sau khi glucose cạn kiệt, nồng độ oxy hòa tan lại tăng lên, dẫn đến một sự kiện cung cấp khác.
Vòng lặp cung cấp này được lặp lại hơn 30 lần và gần 200 µL lượng cung cấp glucose được thêm vào quá trình nuôi cấy trong 6,5 giờ còn lại, nhưng không có sự kiện cung cấp nào dẫn đến sự cạn kiệt hoàn toàn oxy trong pha lỏng. Điều này cho thấy chiến lược cung cấp kích hoạt DO đã được kết hợp thành công với sự trợ giúp của tốc độ truyền oxy cao đạt được bằng cách sục khí với lượng lớn oxy trong các đĩa vi mô FlowerPlate và dẫn đến kiểm soát chặt chẽ tốc độ cung cấp glucose dựa trên các phép đo trực tuyến. Ngoài ra, sự kết hợp của việc cung cấp glucose (gần như) liên tục mà không gây ra tình trạng hạn chế oxy ngăn ngừa sự chuyển dịch chuyển hóa sang tiêu thụ các chất chuyển hóa thứ cấp. Điều này cũng cho phép kiểm soát tốt độ pH của nuôi cấy trong toàn bộ quá trình nuôi cấy.
So với nuôi cấy bằng khí thông thường, lượng thức ăn glucose được thêm vào nhiều hơn năm lần. Điều này một phần là do hạn chế oxy trong nuôi cấy bằng khí thông thường ngay sau khi bắt đầu cung cấp, làm dừng quá trình nuôi cấy; nhưng có thể thấy tác động trong toàn bộ thí nghiệm vì thời gian (dài hơn) xảy ra tình trạng cạn kiệt oxy hoàn toàn trong quá trình nuôi cấy bằng khí thông thường sau mỗi đợt cung cấp. Hồ sơ cung cấp kết quả được phản ánh trong quá trình sinh khối không ổn định, trong đó có thể thấy tín hiệu tăng nhanh ngay sau mỗi lần cung cấp. Ngoài ra, trong các pha hạn chế oxy, độ pH tăng lên, điều này cho thấy sinh vật tạm thời phát triển trên một loại axit được tạo ra dưới dạng chất chuyển hóa tràn (như axetat) vì có thể thấy độ pH tăng tương tự trong nuôi cấy theo mẻ sau khi cạn kiệt glucose. Tuy nhiên, quá trình nuôi cấy dường như chuyển trở lại glucose khi tín hiệu sinh khối tăng lên trong khi độ pH giảm xuống. Sự thay đổi trong quá trình trao đổi chất này dường như lặp lại ít nhất bảy lần và dẫn đến giá trị pH dao động lệch xa điểm đặt và quá trình nuôi cấy rất cơ hội – và khó kiểm soát – khi được nuôi cấy bằng khí thông thường.
Mặc dù lượng glucose cung cấp thấp hơn trong nuôi cấy được sục khí bằng không khí thông thường, nồng độ sinh khối cuối cùng của V. natriegens có vẻ rất giống nhau giữa hai phương pháp nuôi cấy theo mẻ được thể hiện. Một mặt, việc tiêu thụ chất chuyển hóa thứ cấp trong các pha hạn chế oxy có thể bù đắp cho lượng glucose cung cấp thấp hơn vì các nuôi cấy được làm giàu oxy dường như không tạo ra sự dịch chuyển diauxic trong các nuôi cấy được thể hiện. Tuy nhiên, nuôi cấy được sục khí bằng không khí làm giàu oxy nhận được nhiều glucose hơn và glucose cung cấp dường như được tiêu thụ nhanh chóng dựa trên nồng độ oxy giảm sau khi cung cấp glucose. Sự hình thành sinh khối tương đối thấp có thể chỉ ra năng suất glucose thành sinh khối thấp so với nuôi cấy có sục khí và có khả năng tỷ lệ hình thành các sản phẩm (phụ) cao hơn như chất chuyển hóa tràn.
Nhìn chung, chiến lược fed-batch kích hoạt DO được kết hợp chính xác trong cả hai phương pháp nuôi cấy. Và mặc dù phương pháp nuôi cấy được thể hiện bằng lượng lớn oxy không được tối ưu hóa để sản xuất sinh khối cao, nhưng nó cho phép hấp thụ glucose ở mức cao mà không bị hạn chế oxy và cho thấy quá trình nuôi cấy được kiểm soát và dự đoán nhiều hơn mà không có sự thay đổi quá trình trao đổi chất như trong nuôi cấy khí. Tóm lại, hệ thống này chứng minh tác động của việc cung cấp lượng lớn oxy lên nuôi cấy vi sinh vật có thể thúc đẩy nghiên cứu hơn nữa bằng cách triển khai các chiến lược nuôi cấy đa dạng và chính xác với hệ thống BioLector XT.
Phần kết luận
Trong ghi chú ứng dụng này, tiềm năng của lò phản ứng vi sinh BioLector XT để nghiên cứu và tối ưu hóa các quy trình nuôi cấy hiếu khí đã được phát hiện. Sự kết hợp của mô-đun vi lỏng với chế độ O2-up gassing là một công cụ mạnh mẽ để nghiên cứu các chiến lược nuôi cấy khác nhau trong khi ngăn ngừa tình trạng hạn chế oxy (có hại) và có thể giúp thúc đẩy các thông số quy trình tối ưu để cho phép mật độ tế bào và năng suất cao hơn. Bằng cách sử dụng các đĩa vi mô FlowerPlate và nồng độ oxy cao, các sinh vật tiêu thụ oxy cao như E. coli và V. natriegens có thể được cung cấp đủ oxy để ngăn ngừa tình trạng thiếu oxy hoàn toàn và cải thiện hiệu suất nuôi cấy cũng như kiểm soát quy trình.
Minh Khang là nhà phân phối và nhập khẩu trực tiếp thiết bị Lò phản ứng vi sinh hãng Beckman Coulter.


 EN
EN