Andrew Lister, DPhil (Beckman Coulter)
Bài viết dưới đây sẽ trình bày về cách cài đặt thiết bị CytoFLEX để phát hiện và đếm vi khuẩn
Sơ lược
Phát hiện và đếm vi khuẩn có ứng dụng trong nhiều bối cảnh, chẳng hạn như giám sát môi trường và quy trình. Phân tích tế bào dòng chảy có tiềm năng xác định và đếm nhiều loài vi khuẩn khác nhau trong nhiều môi trường khác nhau. Với phương pháp nhuộm thích hợp để cho phép phân biệt rõ ràng các khuẩn lạc hoặc tế bào vi khuẩn khỏi nền môi trường xung quanh, có thể đếm ngay cả những tần suất rất thấp của tải lượng vi khuẩn khá nhanh. Các phương pháp dự đoán có thể nhanh nhưng kém chính xác hơn (ví dụ: phép đo độ đục) hoặc rất chậm khi so sánh (CFU—đơn vị hình thành khuẩn lạc—xác định số lượng bằng nuôi cấy thường mất 48 giờ) và có thể yêu cầu pha loãng nối tiếp để bao gồm nhiều nồng độ tiềm năng, so với một phút hoặc ít hơn bằng FCM (phân tích tế bào dòng chảy).
Quy trình
Quy trình tiêu chuẩn
Các môi trường nuôi cấy của từng loài vi khuẩn được thử nghiệm bằng phép đo mật độ tế bào và được huyền phù lại trong PBS thành 0,5 đơn vị McFarland, hoặc danh nghĩa là 150 x 106 mL-1 , được xác định là [1x]. Các phần nhỏ được pha loãng thêm với PBS thành nồng độ 1/10x hoặc 1/100x, tương ứng với danh nghĩa là 15 hoặc 1,5 x 103 µL-1, trước khi phân tích trên CytoFLEX.
Các mẫu được chạy mà không nhuộm hoặc được dán nhãn bằng hỗn hợp thuốc nhuộm axit nucleic SYTO vital dye từ bộ dụng cụ SYTO BC [Thermo Fischer Scientific]. Hướng dẫn của nhà sản xuất yêu cầu sử dụng thuốc nhuộm này ở mức 1 µL dung dịch gốc (trong DMSO) trên 1 mL mẫu, nhưng điều này được phát hiện là gây ra hiện tượng nhuộm thứ cấp đáng kể trong thực tế. Việc nhuộm rất đạt yêu cầu đã đạt được bằng cách tạo ra dung dịch gốc thứ cấp ở cùng tỷ lệ này (1 µL dung dịch gốc chính trong 1 mL PBS) được sử dụng ở tỷ lệ 5 µL trên 500 µL mẫu aliquot, hoặc 1% nồng độ khuyến nghị.
Cấu hình thiết bị
| Cấu hình thiết bị | VSSC | Dạng đĩa hoặc dạng ống |
| Any: B4-R0-V0 trở lên | Không | Hoặc |
Bất kỳ cấu hình CytoFLEX tiêu chuẩn nào cũng có thể được sử dụng cho xét nghiệm này vì nó chỉ yêu cầu tia laser xanh cho tán xạ thuận và tán xạ ngang (FSC & SSC) và huỳnh quang SYTO màu xanh lá cây được đo trong kênh FITC bình thường.
Cài đặt đếm vi khuẩn
Vì vi khuẩn nhỏ hơn hầu hết các tế bào nhân chuẩn thường được phân tích bằng FCM nên cần phải sửa đổi cài đặt độ lợi cho tín hiệu FSC (phân tán thuận) và SSC (phân tán bên) từ mặc định CytoFLEX. Độ lợi huỳnh quang nằm trong phạm vi bình thường.
Việc thu thập trong thời gian cố định được ưu tiên hơn việc đếm cố định để phân tích thể tích không đổi và giúp việc hiệu chỉnh trừ số đếm nền cần thiết trở nên đơn giản hơn.
Các đặc tính ban đầu được thực hiện ở tốc độ dòng chảy 10 µL mỗi phút (Thấp) trong 30 giây, do đó thể tích cố định là 5 µL cho mỗi mẫu.
Kết quả
Chuỗi biểu đồ sau đây đều hiển thị biểu đồ mật độ phân tán log-log không có bộ lọc, với cổng ‘vi khuẩn’ chung (màu cánh sen). Ngoại trừ các đối chứng, biểu đồ này hiển thị một phần nhỏ vi khuẩn không nhuộm màu.
Biểu đồ thứ hai là một biểu đồ phân tán logarit kép khác, nhưng lần này là biểu đồ chấm, cho phép hiển thị màu sắc. Vùng thứ hai được định nghĩa ở đây là ‘sống’ (màu xanh) dựa trên quần thể dương tính với SYTO.
Biểu đồ cuối cùng là lớp phủ biểu đồ histogram tham số đơn của huỳnh quang màu xanh lá cây (SYTO), so sánh các phần không có nhãn và có nhãn của vi khuẩn đang xét, với vùng ‘SYTO+’ được sử dụng để tạo cổng ngược cho biểu đồ thứ hai.
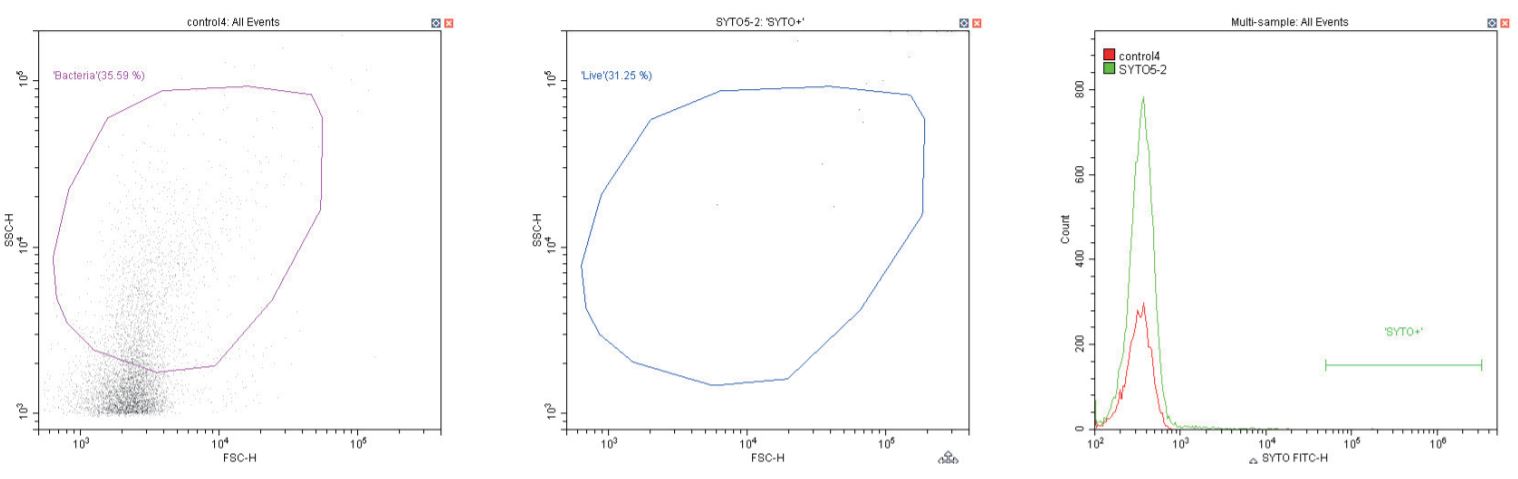
Kiểm soát âm tính (bên trái) Chỉ có vỏ bọc; Kiểm soát âm tính (ở giữa và bên phải) vỏ bọc và thuốc nhuộm SYTO ở nồng độ khuyến nghị 1 µL/1 mL
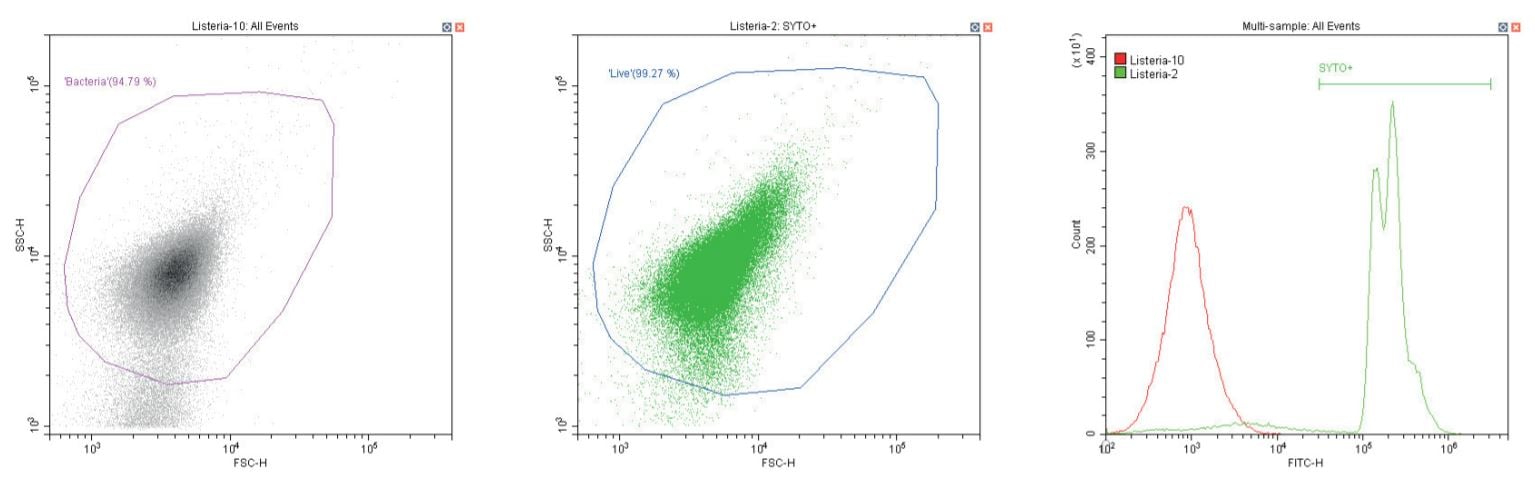
Trực khuẩn Gram dương Listeria monocytogenes . Không nhuộm (trái) và nhuộm (giữa)
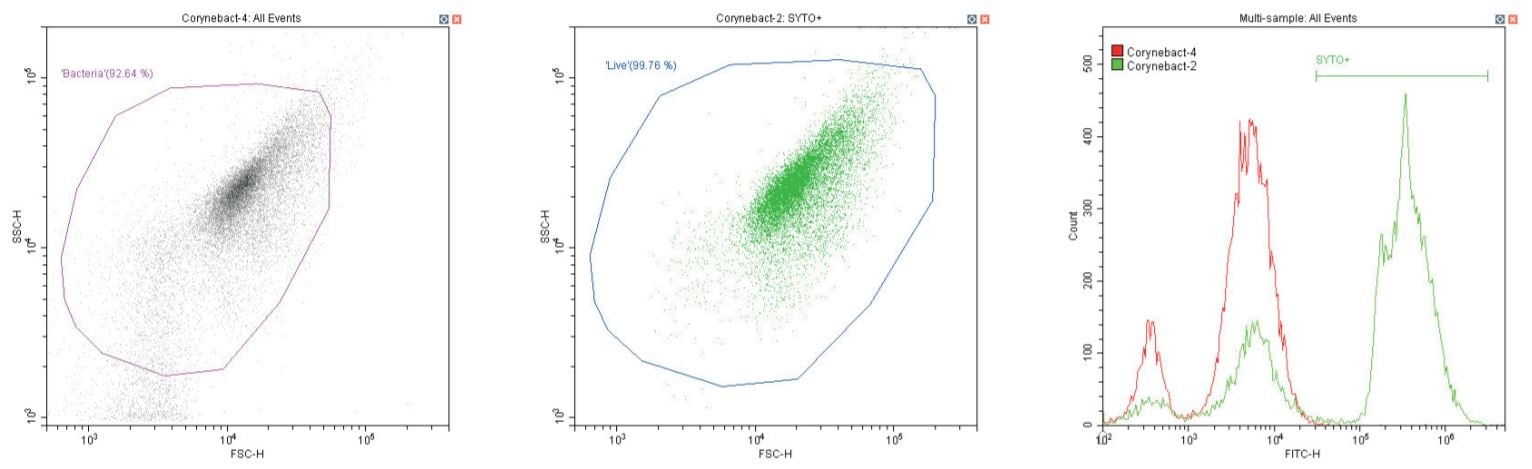
Trực khuẩn Gram dương Corynebacterium spp . Không nhuộm (trái) và nhuộm (giữa)
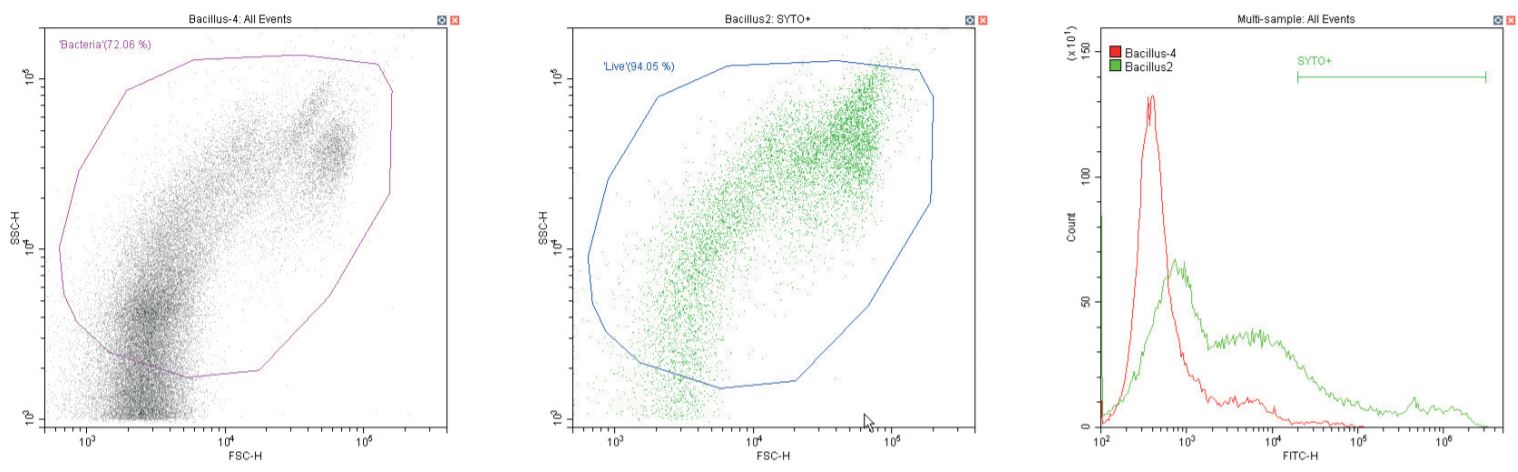
Bacillus spp . Gram dương . Không nhuộm (trái) và nhuộm (giữa)
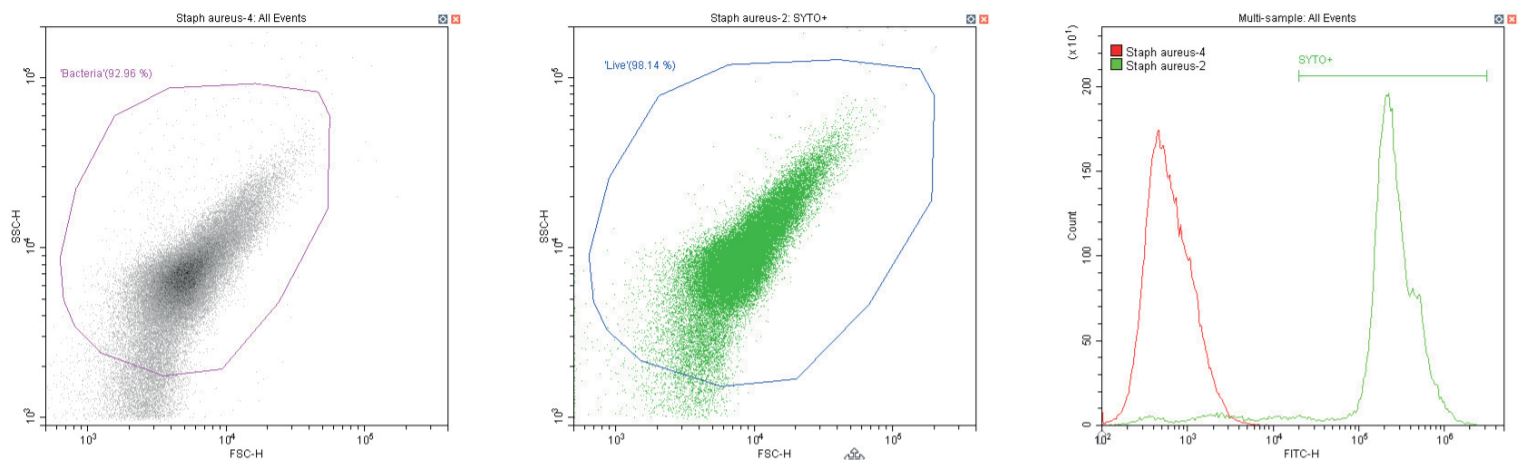
Cầu khuẩn Gram dương Staphylococcus aureus . Không nhuộm (trái) và nhuộm (giữa)
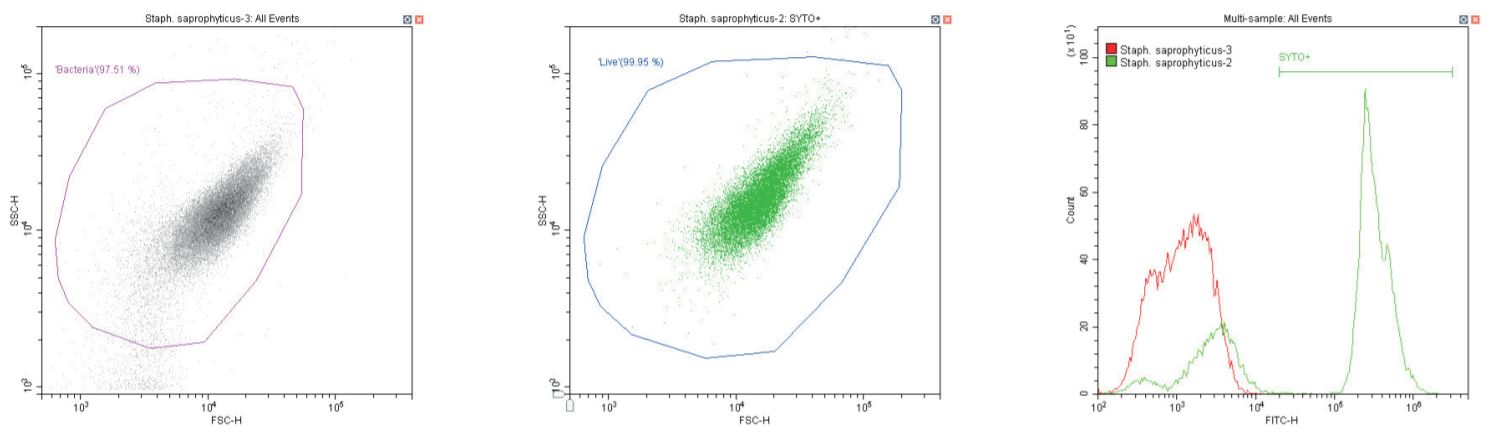
Cầu khuẩn Gram dương Staphylococcus saprophyticus . Không nhuộm (trái) và nhuộm (giữa)
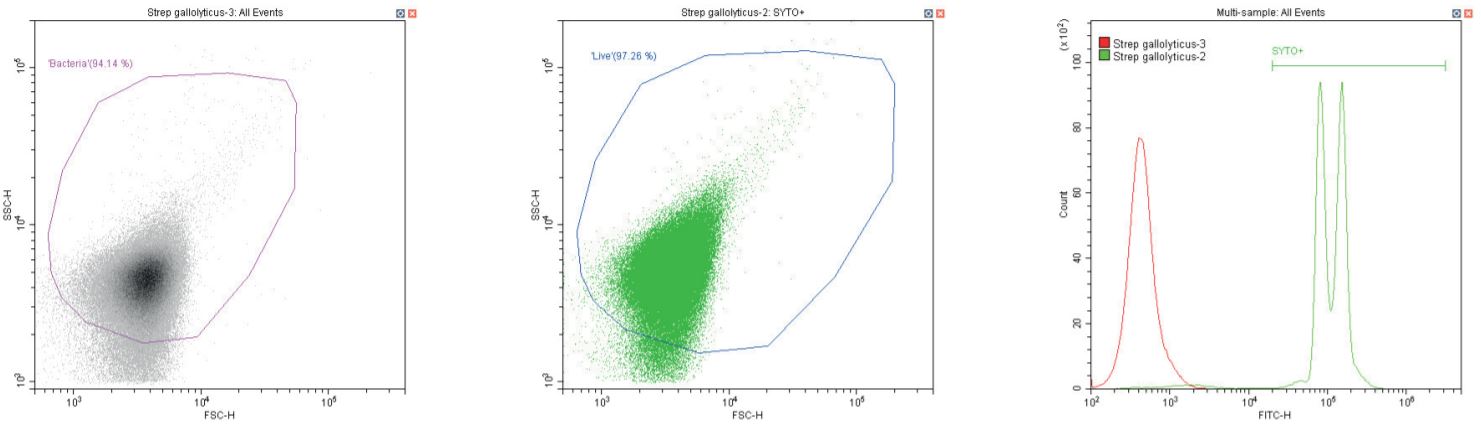
Cầu khuẩn Gram dương Streptococcus gallolyticus . Không nhuộm (trái) và nhuộm (giữa)
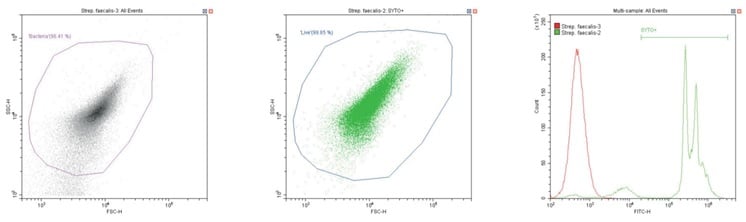
Cầu khuẩn Gram dương Streptococcus faecalis . Không nhuộm (trái) và nhuộm (giữa)
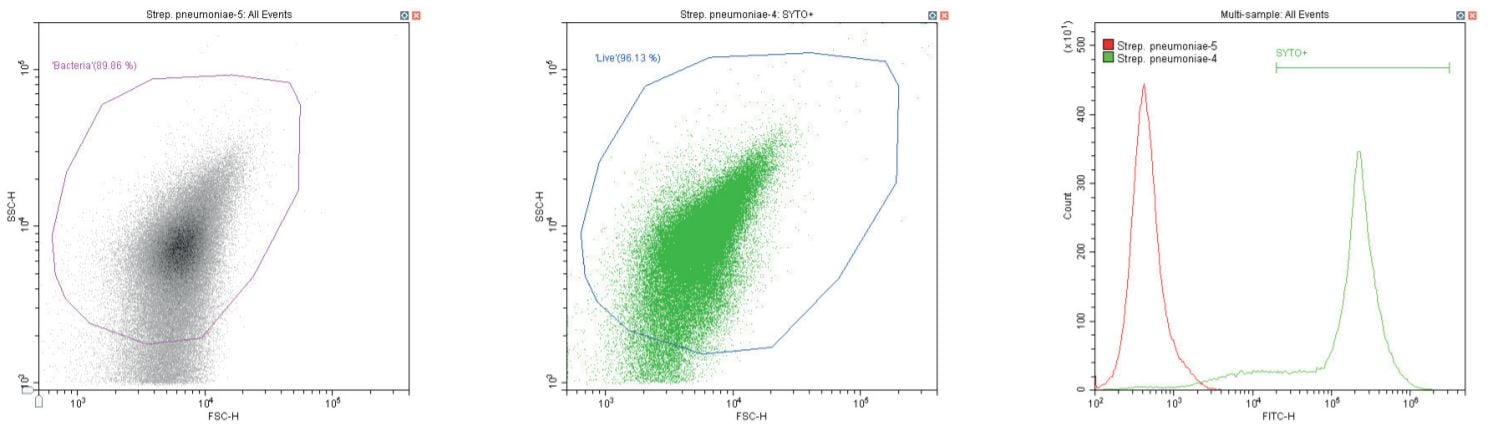
Cầu khuẩn Gram dương Streptococcus pneumoniae . Không nhuộm (trái) và nhuộm (giữa)
Ghi chú
Ngay cả khi làm việc ở nồng độ thuốc nhuộm SYTO thấp hơn (thấp tới 1% so với khuyến nghị), vẫn cần phải cẩn thận nếu mẫu nhuộm tiếp theo là mẫu không nhuộm (kiểm soát âm tính). Điều này có thể được theo dõi bằng cách sử dụng biểu đồ huỳnh quang SYTO so với thời gian trong quá trình thu thập mẫu. Cơ chế giả định là thuốc nhuộm hấp phụ vào ống mẫu và giải phóng sau đó. Chạy một lượng nhỏ natri hypoclorit loãng (10%) làm mẫu và sau đó rửa bằng DI kiểm soát vấn đề này một cách hiệu quả.
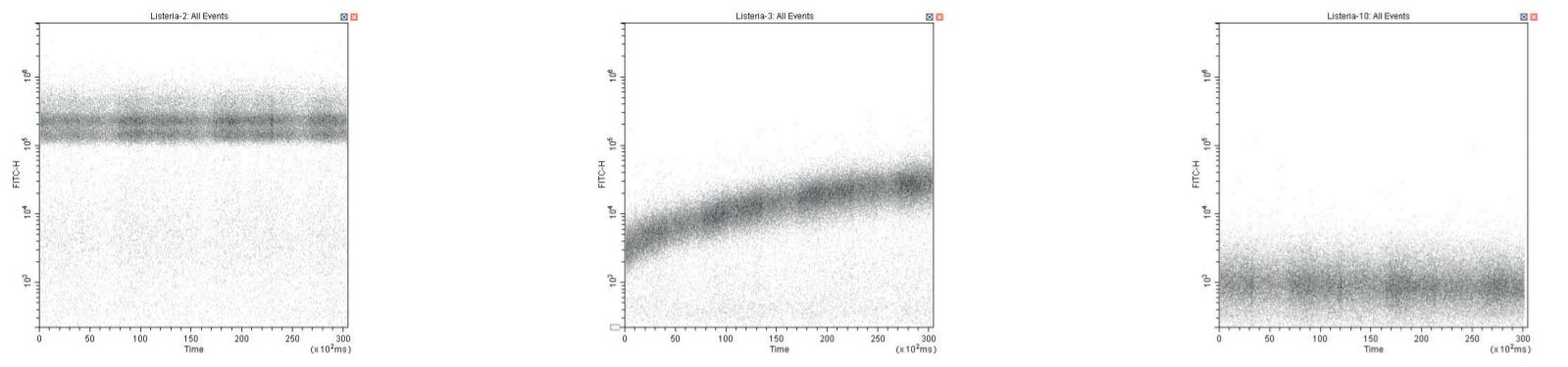
QC theo tiến trình thời gian cho thấy mẫu dương tính được gắn nhãn SYTO (bên trái), đối chứng âm tính cho thấy sự gắn nhãn theo tiến trình thời gian rõ rệt do sự hấp phụ và giải phóng thuốc nhuộm, và đối chứng âm tính chính xác sau khi làm sạch đường ống mẫu (bên phải).
Các kết quả được trình bày đại diện cho các kết quả được tạo ra trên Máy đếm tế bào dòng chảy CytoFLEX của Beckman Coulter. Vì có sự khác biệt về hiệu suất giữa các máy phân tích, tác giả không thể đảm bảo hình thức tương tự khi sử dụng các máy đếm tế bào dòng chảy chảy khác.


 EN
EN