Trong kính hiển vi ánh sáng truyền qua, chất lượng mẫu vật không phải lúc nào cũng cho phép quan sát và ghi hình ảnh dễ dàng với độ tương phản vượt trội trong chế độ chụp ảnh trường sáng đơn giản. Thí nghiệm xử lý các mẫu vật vốn có độ tương phản thấp, chẳng hạn như vi khuẩn không nhuộm màu, lát mô mỏng và tế bào sống bám dính, dựa vào các kỹ thuật tăng cường độ tương phản chuyên dụng để hỗ trợ chụp ảnh các mẫu gần như trong suốt này. Trong quá trình kiểm tra các mẫu vật không bị nhuộm màu, sự hấp thụ ánh sáng kém của mẫu vật dẫn đến sự thay đổi cực kỳ nhỏ trong chênh lệch phân bố cường độ giữa mẫu vật và nền. Khi nền sáng, mắt người cần dao động cường độ cục bộ ít nhất từ 10 đến 20 phần trăm để có thể nhận ra chi tiết mẫu vật. Thật không may, mức điều biến này hiếm khi được thấy ở các mẫu trong suốt, chúng thường được hiển thị gần như vô hình trên nền có cường độ tương tự. Ánh sáng truyền qua , khi được sử dụng trong kính hiển vi quang học, dùng để chỉ bất kỳ phương thức chụp ảnh nào trong đó ánh sáng truyền từ nguồn chiếu sáng ở phía đối diện của mẫu vật đến vật kính (do đó, ánh sáng được truyền qua mẫu vật). Các kỹ thuật tăng cường độ tương phản được mô tả trong phần này thể hiện nhiều phương pháp chuẩn bị mẫu cũng như các thủ thuật quang học tạo ra sự thay đổi cường độ hữu ích cho việc quan sát và chụp ảnh.
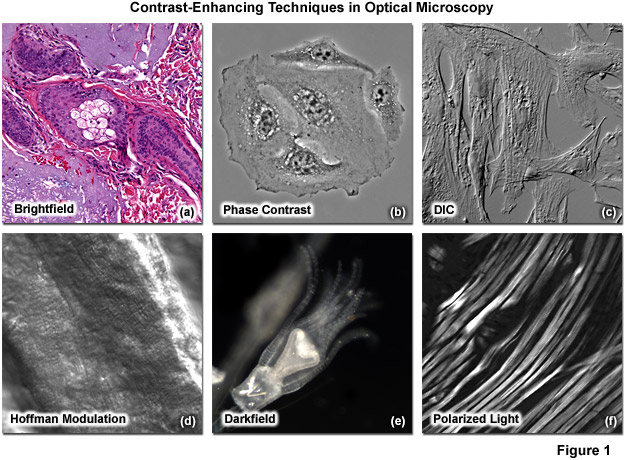
Minh họa trong Hình 1 là nhiều kỹ thuật tăng cường độ tương phản phổ biến thường được sử dụng trong kính hiển vi ánh sáng truyền qua. Phần mô mỏng trong Hình 1(a) cho thấy ung thư biểu mô tế bào đáy ở người được nhuộm bằng eosin và hematoxylin để tạo ra độ tương phản màu trong chế độ hình ảnh trường sáng. Hình 1(b) cho thấy các tế bào HeLa sống trong một bình nuôi cấy mô nhựa được chụp ảnh tương phản pha. Nuôi cấy cố định các tế bào Muntjac Ấn Độ được gắn trong môi trường nước được trình bày dưới dạng hình ảnh tương phản giao thoa vi sai trong Hình 1(c). Một phần mô tươi của cơ tim chuột được ngâm trong dung dịch nước muối được hiển thị trong bảng Hình 1(d), trong đó độ tương phản được tạo ra bằng cách sử dụng độ tương phản điều biến Hoffman (hoặc ZEISS VAREL), một kỹ thuật chiếu sáng xiên. Độ tương phản sáng-tối rực rỡ quan sát được với ánh sáng trường tối được thể hiện trong Hình 1(e) bằng cách sử dụng mẫu vật Obelia hydroid. Cuối cùng, sợi cơ xương thỏ (Hình 1(f)) nằm trong số các mẫu vật sinh học có tính lưỡng chiết và thể hiện độ tương phản trong ánh sáng phân cực.
Kỹ thuật chiếu sáng trường sáng
Một trong những kỹ thuật cơ bản và phổ biến được sử dụng trong mọi dạng kính hiển vi quang học trong ba thế kỷ qua, chiếu sáng trường sáng phụ thuộc vào sự thay đổi độ hấp thụ ánh sáng, chiết suất hoặc màu sắc để tạo ra độ tương phản. Khi ánh sáng đi qua mẫu vật, các vùng làm thay đổi hướng, tốc độ và/hoặc quang phổ của mặt sóng sẽ tạo ra sự chênh lệch quang học (độ tương phản) khi các tia được tập hợp và hội tụ bởi vật kính. Độ phân giải trong hệ thống trường sáng phụ thuộc vào cả vật kính và khẩu độ số của tụ điện, và cần có môi trường ngâm ở cả hai mặt của mẫu thử (đối với các kết hợp khẩu độ số vượt quá giá trị 2,3). Máy ảnh kỹ thuật số cung cấp dải động rộng và độ phân giải không gian cần thiết để ghi lại thông tin có trong hình ảnh trường sáng. Ngoài ra, thuật toán trừ nền, sử dụng các khung hình trung bình được chụp không có mẫu vật trong đường quang, sẽ làm tăng độ tương phản đáng kể.
Hình ảnh trường sáng đơn giản, với kính hiển vi được điều chỉnh phù hợp với độ chiếu sáng Köhler, cung cấp một mức độ thông tin hạn chế về đường viền tế bào, vị trí nhân và vị trí của các túi lớn hơn trong mẫu vật không nhuộm. Độ tương phản trong hình ảnh trường sáng phụ thuộc vào sự khác biệt về độ hấp thụ ánh sáng, chiết suất hoặc màu sắc. Sự chênh lệch quang học (độ tương phản) được phát triển khi ánh sáng truyền qua mẫu vật làm thay đổi hướng, tốc độ hoặc đặc điểm quang phổ của mặt sóng hình ảnh. Kỹ thuật này hữu ích hơn với các mẫu được nhuộm bằng thuốc nhuộm hấp thụ ánh sáng khả kiến (chẳng hạn như eosin và hematoxylin; xem Hình 1(a)). Tuy nhiên, sự thiếu tương phản chung ở chế độ trường sáng khi kiểm tra các mẫu không nhuộm màu khiến kỹ thuật này tương đối vô dụng đối với các nghiên cứu nghiêm túc về cấu trúc tế bào sống.
Độ tương phản pha
Được mô tả lần đầu tiên bởi Frits Zernike người Hà Lan vào năm 1934, độ tương phản pha đã mang lại cho người phát hiện ra nó giải Nobel vật lý năm 1953 đồng thời cách mạng hóa nghiên cứu y sinh cơ bản về tế bào sống. Kỹ thuật này lý tưởng cho các mẫu vật mỏng không nhuộm màu (chẳng hạn như tế bào nuôi cấy trên thủy tinh), dày khoảng 5 đến 10 micromet phía trên nhân nhưng dày chưa đến 1 micromet ở ngoại vi. Những mẫu vật như vậy hầu như không thể hiện bất kỳ sự hấp thụ ánh sáng nào trong phần quang phổ nhìn thấy được và mắt người không thể phát hiện ra chúng trong ánh sáng trường sáng và trường tối. Độ tương phản pha (như minh họa trong Hình 1(b)) sử dụng một cơ chế quang học để chuyển những thay đổi nhỏ về pha thành những thay đổi biên độ tương ứng, có thể được hình dung dưới dạng những khác biệt về độ tương phản hình ảnh. Kính hiển vi phải được trang bị một tụ quang chuyên dụng có chứa một vòng hoặc một loạt các vòng phù hợp với một tập hợp các vật kính chứa các vòng pha (Ph) trong mặt phẳng tiêu cự phía sau. Tương phản pha là một phương pháp tuyệt vời để tăng độ tương phản khi quan sát hoặc chụp ảnh các tế bào sống trong môi trường nuôi cấy, nhưng thường tạo ra các quầng sáng bao quanh đường viền của các đặc điểm rìa. Những quầng sáng này là các tạo tác quang học thường làm giảm khả năng hiển thị của các chi tiết ranh giới. Kỹ thuật này không hữu ích đối với các mẫu vật dày (chẳng hạn như các phần mô thực vật và động vật) vì sự dịch chuyển pha xảy ra ở các vùng bị loại bỏ khỏi mặt phẳng tiêu điểm làm biến dạng chi tiết hình ảnh. Hơn nữa, các mảnh vụn trôi nổi và các vật thể pha nằm ngoài tiêu điểm khác sẽ cản trở việc tạo ảnh các tế bào bám trên lam kính.
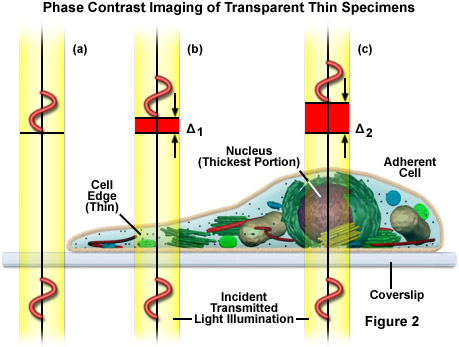
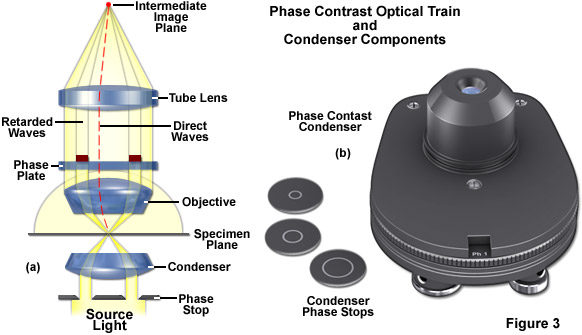
Trong cấu hình kính hiển vi tương phản pha, màng chắn khẩu độ của tụ điện được thay thế bằng một điểm dừng pha (kích thước của nó phụ thuộc vào vật kính và khẩu độ số của tụ điện) để chiếu sáng mẫu vật thông qua các thành phần quang học của tụ điện theo kiểu ánh sáng hình nón rỗng, như minh họa trong Hình 3(a). Các mặt sóng này đi vào vật kính và hình ảnh của điểm dừng pha được tạo ra trong mặt phẳng tiêu điểm phía sau (đồng tử vật kính). Được đặt trong mặt phẳng tiêu cự phía sau vật kính là một vòng hoặc tấm pha không chỉ làm giảm ánh sáng trực tiếp, phát ra từ điểm dừng pha trong tụ điện mà còn bổ sung thêm sự dịch pha không đổi cho ánh sáng này. Nếu mẫu chứa các cấu trúc phụ có chiết suất hỗn hợp, thì các thực thể này sẽ dẫn ánh sáng từ sóng trực tiếp sang các đường đi mới (đường chấm màu đỏ trong Hình 3(a)). Các mặt sóng bị nhiễu xạ bởi mẫu vật (trong thực tế, những mặt sóng chứa thông tin cấu trúc) sẽ không đi qua vòng pha trong vật kính, nghĩa là chúng sẽ không bị suy giảm hoặc bị chậm lại. Tất cả các mặt sóng cuối cùng được kết hợp lại để tạo thành hình ảnh trung gian bằng thấu kính ống.
Một hiện tượng chính của hình ảnh tương phản pha là các quầng sáng xuất hiện trên đường viền xung quanh mẫu vật. Quầng sáng xuất hiện trong kính hiển vi tương phản pha vì vòng tròn trễ pha (và mật độ trung tính) nằm trong tấm pha khách quan cũng truyền một lượng nhỏ ánh sáng nhiễu xạ từ mẫu vật (nó không bị hạn chế chỉ truyền qua sóng xung quanh). Vấn đề trở nên phức tạp hơn bởi thực tế là chiều rộng của mặt sóng xung quanh ánh sáng không nhiễu xạ (bậc 0) chiếu lên bản pha bởi hình khuyên của tụ điện nhỏ hơn chiều rộng thực tế của vòng bản pha. Các mẫu vật dày, thường có cấu trúc chồng chéo cao, tạo ra các tạo tác hào quang nghiêm trọng. Do đó, độ tương phản pha là phương pháp chỉ được khuyến nghị cho các mẫu rất mỏng trong đó một số cấu trúc không nằm chồng lên nhau. Trong một mẫu vật dày, các chi tiết có thể được trộn lẫn thành một hình ảnh mà trong phân tích cuối cùng không còn rõ ràng nữa.
Độ tương phản pha yêu cầu các vật kính đặc biệt được trang bị vòng pha gần đồng tử hoặc khẩu độ phía sau. Chúng rất dễ nhận biết bằng dòng chữ màu xanh lá cây biểu thị kích thước của điểm dừng pha ngưng tụ tương ứng: Ph1, Ph2 hoặc Ph3. Nếu bạn đặt vật kính như vậy trước ánh sáng và nhìn vào đồng tử từ đầu có ren, bạn sẽ có thể thấy vòng pha màu xám/trong suốt. Bộ ngưng tụ yêu cầu một, hai hoặc ba điểm dừng pha, tùy thuộc vào vật kính tương phản pha được gắn vào trục xoay của kính hiển vi. Đường kính vòng yêu cầu tăng theo khẩu độ số (khẩu độ cao yêu cầu đường kính tối đa (Ph3), ví dụ 0,9 trong không khí hoặc 1,3 khi ngâm trong dầu). Ba kích cỡ có sẵn và đủ cho tất cả các mục tiêu (Hình 3(b)). Nếu bạn sử dụng độ tương phản pha chỉ với một kích thước vòng, thì một điểm dừng plug-in có thể gắn và tháo rời dễ dàng cho tụ điện sẽ đủ. Đĩa tháp pháo có nhiều giá đỡ sẽ thuận tiện hơn vì nó chứa tất cả ba điểm dừng pha và cho phép chuyển đổi rất nhanh trong quá trình chụp ảnh. Các lỗ mở bổ sung có sẵn cho mống mắt khẩu độ cần thiết trong chiếu sáng trường sáng và cho màng chắn trường tối.
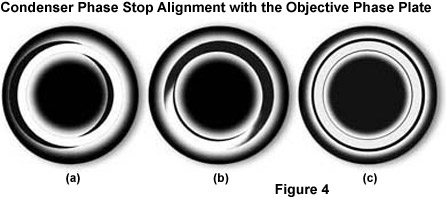
Hình ảnh của mẫu vật trong độ tương phản pha có thể bị ảnh hưởng bằng cách chọn độ trễ thích hợp của chùm tia trực tiếp (không nhiễu xạ) thông qua việc lựa chọn cẩn thận vòng pha trong vật kính. Tùy thuộc vào giá trị độ trễ được chọn, các vật thể có chiết suất cao hơn môi trường xung quanh sẽ sáng hơn hoặc tối hơn môi trường xung quanh. Điều này còn được gọi là độ tương phản pha dương hoặc âm. Trong kính hiển vi mới, độ tương phản pha dương là tiêu chuẩn, trong đó độ tối của các đặc điểm của vật thể tăng theo chiết suất của chúng. Hiệu ứng này mô phỏng sự hấp thụ của mắt người quan sát ở những khu vực có chỉ số khúc xạ cao hơn tạo ra các đặc điểm có độ tương phản cao. Dấu ấn này được coi là tối ưu, đặc biệt với các tế bào và mô trong môi trường nước vì nhân tế bào và các bào quan chẳng hạn, có vẻ sẫm màu hơn so với tế bào chất. Đối với một số ứng dụng, chẳng hạn như kiểm tra tế bào tinh trùng, độ tương phản pha âm có thể tạo ra nhiều chi tiết mẫu hơn so với độ tương phản pha dương truyền thống.
Độ tương phản chênh lệch
Kính hiển vi tương phản giao thoa vi sai (DIC ; Hình 1(c)) yêu cầu ánh sáng phân cực phẳng và lăng kính cắt ánh sáng bổ sung (Nomarski) để phóng đại những khác biệt nhỏ về gradient độ dày mẫu và chiết suất. Ví dụ, lớp lipid kép tạo ra độ tương phản tuyệt vời trong DIC do sự khác biệt về chỉ số khúc xạ giữa pha nước và pha lipid của tế bào. Ngoài ra, ranh giới tế bào trong các tế bào thực vật và động vật có vú bám dính tương đối phẳng, bao gồm màng sinh chất, nhân, không bào, ty thể và các sợi căng thẳng, thường tạo ra độ dốc đáng kể, được dễ dàng chụp ảnh bằng DIC. Trong các mô thực vật, thành tế bào lưỡng chiết làm giảm độ tương phản của DIC ở một mức độ hạn chế, nhưng một hệ thống sắp xếp hợp lý sẽ cho phép hình dung được màng nhân và không bào, một số ty thể, lục lạp và nhiễm sắc thể ngưng tụ trong tế bào biểu bì. Độ tương phản giao thoa vi sai là một kỹ thuật quan trọng để chụp ảnh các mô thực vật và động vật dày vì ngoài độ tương phản tăng lên, DIC còn thể hiện độ sâu trường ảnh giảm ở khẩu độ rộng, tạo ra một phần quang học mỏng của mẫu vật dày. Hiệu ứng này cũng có lợi cho việc chụp ảnh các tế bào bám dính nhằm giảm thiểu hiện tượng mờ nhòe do các mảnh vụn nổi trong môi trường nuôi cấy gây ra.
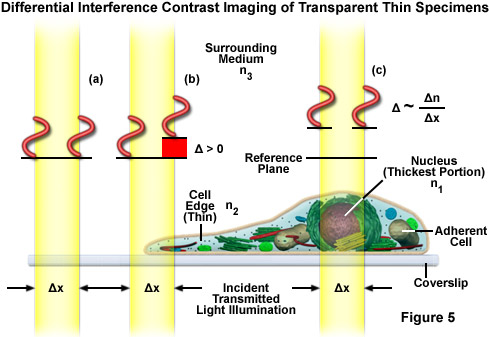
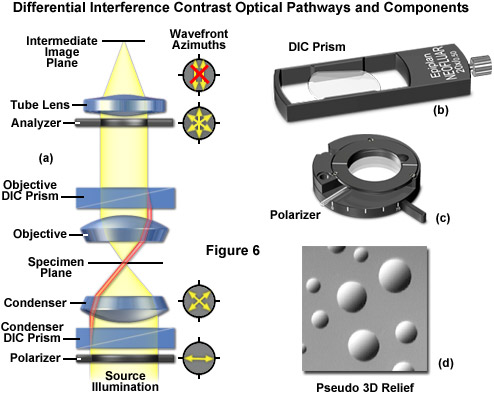
Hình 6 minh họa đường đi của tia sáng trong kính hiển vi tương phản giao thoa vi sai (DIC) tương tự như ánh sáng truyền qua phân cực. Trong DIC (so với ánh sáng phân cực), hai lăng kính lưỡng chiết (Hình 6(b)) được chèn vào hệ quang học, một ở bộ ngưng tụ và một ở gần khẩu độ của vật kính. Lăng kính ở bộ ngưng tụ thực hiện phép phân tách vectơ của ánh sáng phân cực tuyến tính trước đó (Hình 6(c)) thành hai hướng dao động phân cực vuông góc với nhau, và dịch chuyển các chùm tia này theo chiều ngang sao cho xuất hiện một sự dịch chuyển nhỏ của các mặt sóng tại những vùng có độ dày hoặc chỉ số khúc xạ thay đổi. Nếu hai chùm tia phân tách này đi qua đúng cùng một cấu trúc, sẽ không có sự khác biệt thêm về đường đi trong mẫu vật (Hình 5(a) và Hình 5(c)). Tuy nhiên, nếu hai chùm tia phân tách này gặp các điều kiện hơi khác nhau, mỗi chùm tia sẽ trải qua một độ dài đường đi hơi khác nhau trong quá trình di chuyển đến mặt phẳng ảnh trung gian (Hình 5(b)).
Như đã thảo luận, các chùm ánh sáng DIC phân tách đi vào và đi qua mẫu trong đó đường đi sóng của chúng bị thay đổi theo độ dày, độ dốc và chỉ số khúc xạ khác nhau của mẫu. Những biến đổi này gây ra sự thay đổi đường truyền sóng của cả hai chùm tia truyền qua các khu vực của bất kỳ chi tiết mẫu thử nào nằm gần nhau. Khi các chùm tia song song đi vào vật kính, chúng sẽ hội tụ phía trên mặt phẳng tiêu điểm phía sau, nơi chúng đi vào lăng kính DIC thứ hai kết hợp hai chùm tia ở một khoảng cách xác định bên ngoài lăng kính. Điều này loại bỏ lực cắt (khoảng cách giữa các sóng) và độ lệch đường đi ban đầu giữa các cặp chùm tia. Do đã đi ngang qua mẫu thử nên đường truyền của các chùm tia song song không có cùng độ dài (chênh lệch đường quang) đối với các khu vực khác nhau của mẫu thử.
Điều biến Hoffman và Tương phản VAREL
Thường được gọi là “poor man’s DIC”, độ tương phản điều biến Hoffman (HMC) là một kỹ thuật chiếu sáng xiên giúp tăng cường độ tương phản trong các tế bào và mô sống bằng cách phát hiện độ dốc pha quang học (xem Hình 1(d)). Cấu hình kính hiển vi cơ bản bao gồm một bộ lọc không gian biên độ quang học, được gọi là bộ điều biến, được lắp vào mặt phẳng tiêu cự phía sau của vật kính. Cường độ ánh sáng đi qua bộ điều biến thay đổi trên và dưới giá trị trung bình, theo định nghĩa, giá trị này được cho là được điều biến. Kết hợp với bộ điều biến vật kính là một khe hở ngoài trục được đặt trong mặt phẳng tiêu cự phía trước của tụ quang để hướng ánh sáng xiên về phía mẫu vật. Không giống như tấm pha trong kính hiển vi tương phản pha, bộ điều biến Hoffman được thiết kế để không làm thay đổi pha ánh sáng truyền qua; đúng hơn là nó ảnh hưởng đến cực đại bậc 0 chính để tạo ra độ tương phản. Độ tương phản điều biến Hoffman không bị cản trở khi sử dụng vật liệu lưỡng chiết (chẳng hạn như đĩa Petri bằng nhựa) trong đường quang, vì vậy kỹ thuật này hữu ích hơn khi kiểm tra mẫu vật trong các thùng chứa được chế tạo bằng vật liệu polyme. Mặt khác, HMC sản xuất một số tạo tác quang học khiến kỹ thuật này ít hữu ích hơn so với kỹ thuật tương phản pha hoặc DIC để chụp ảnh tế bào sống trên nắp kính.
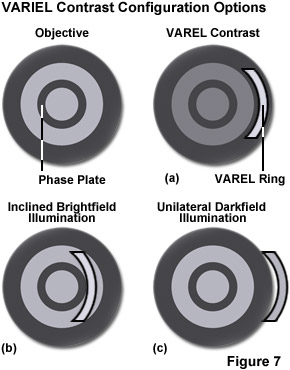
Định hướng dễ dàng đạt được và duy trì do tính chất đồng tâm của khe. Hơn nữa, do vị trí của vòng VAREL trong vật kính nên các vòng VAREL và độ tương phản pha có thể được kết hợp trong cùng một vật kính. Điều này tạo nên một phương pháp chụp ảnh tế bào trong các bình nuôi cấy với chi phí rất thấp. Các vấn đề về hình ảnh trong cả ứng dụng nuôi cấy mô truyền thống và thông thường đều có thể được giải quyết bằng phương pháp này. Đây là một lựa chọn thành công để kiểm tra các vật thể sống (vi thao tác) và một loạt các cấu trúc có độ dày quang học khác nhau có thể dễ dàng được chụp ảnh bằng VAREL. Ngay cả các bình nuôi cấy có đáy cong cũng cho phép tạo ra hình ảnh hữu ích. Riêng độ tương phản pha đôi khi không thành công trong những trường hợp như vậy vì đế buồng cong hoạt động giống như một thấu kính và làm suy yếu sự chồng chất của các vòng pha. Một thanh trượt chứa hai trong số các khu vực được đề cập để cho phép thực hiện chiếu sáng từ bên trái hoặc bên phải, theo yêu cầu. Điều này giúp có thể so sánh các tế bào ngay cả ở gần các cạnh của lỗ trên tấm microtiter.
Chiếu sáng trường tối
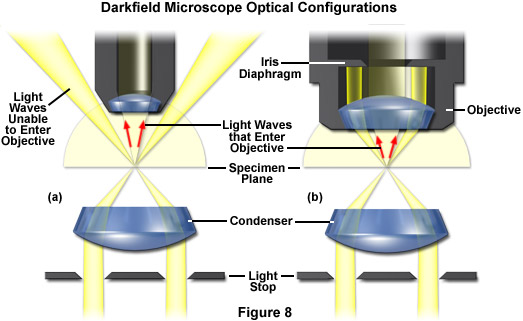
Phương pháp xung quanh kính hiển vi trường tối, mặc dù được sử dụng rộng rãi để chụp ảnh các mẫu vật trong suốt trong suốt Thế kỷ 19 và 20, nhưng lại bị hạn chế sử dụng đối với các tế bào và sinh vật bị cô lập về mặt vật lý (như được trình bày trong Hình 1(e)). Trong kỹ thuật này, tụ điện hướng một hình nón ánh sáng lên mẫu vật ở các góc phương vị cao sao cho các mặt sóng bậc nhất không đi trực tiếp vào thành phần thấu kính vật kính phía trước. Ánh sáng truyền qua mẫu vật bị nhiễu xạ, phản xạ và/hoặc khúc xạ bởi sự gián đoạn quang học (chẳng hạn như màng tế bào, nhân và các bào quan bên trong) cho phép các tia mờ này đi vào vật kính. Sau đó, mẫu vật có thể được hiển thị dưới dạng một vật sáng trên nền đen. Thật không may, ánh sáng bị phân tán bởi các vật thể bị loại bỏ khỏi mặt phẳng tiêu điểm cũng góp phần tạo nên hình ảnh, do đó làm giảm độ tương phản và che khuất chi tiết mẫu vật. Hiện tượng giả này còn phức tạp hơn bởi thực tế là bụi và mảnh vụn trong buồng tạo ảnh cũng góp phần đáng kể vào hình ảnh thu được. Hơn nữa, các tế bào bám dính mỏng thường có tín hiệu rất yếu, trong khi các mô thực vật và động vật dày chuyển hướng quá nhiều ánh sáng vào đường dẫn mục tiêu, làm giảm hiệu quả của kỹ thuật.
Ánh sáng phân cực
Kính hiển vi ánh sáng phân cực là một kỹ thuật tăng cường độ tương phản giúp cải thiện đáng kể chất lượng hình ảnh thu được bằng vật liệu lưỡng chiết khi so sánh với các kỹ thuật khác như chiếu sáng trường sáng và trường tối, độ tương phản pha, độ tương phản giao thoa vi sai, huỳnh quang và độ tương phản điều biến Hoffman. Kính hiển vi ánh sáng phân cực có độ nhạy cao và có thể được sử dụng cho cả nghiên cứu định tính và định lượng nhắm vào nhiều loại mẫu vật dị hướng. Kính hiển vi phân cực định tính khá phổ biến trong thực tế, tuy nhiên, khía cạnh định lượng của kính hiển vi ánh sáng phân cực, được áp dụng chủ yếu trong tinh thể học, là một chủ đề khó hơn nhiều và chủ yếu được sử dụng bởi các nhà khoáng vật học, địa chất và nhà hóa học. Những tiến bộ ổn định đạt được trong vài năm qua về kính hiển vi ánh sáng phân cực có độ nhạy cao đã cho phép các nhà sinh học kiểm tra đặc tính lưỡng chiết của một số tổ hợp tế bào phụ dị hướng.
Kính hiển vi ánh sáng phân cực (Hình 1(f)) được thực hiện bằng cách xem mẫu giữa các phần tử phân cực chéo được lắp vào chuỗi quang học trước tụ quang và sau vật kính. Các tập hợp bên trong tế bào có đặc tính lưỡng chiết, chẳng hạn như thành tế bào thực vật, hạt tinh bột và trục phân bào, cũng như mô cơ, quay mặt phẳng phân cực ánh sáng, xuất hiện sáng trên nền tối. Mô cơ thỏ được minh họa trong Hình 1(f) là một ví dụ về kính hiển vi ánh sáng phân cực được áp dụng để quan sát mô sống. Lưu ý rằng kỹ thuật này bị hạn chế bởi sự xuất hiện của hiện tượng lưỡng chiết trong tế bào và mô sống và vẫn chưa được khám phá đầy đủ. Như đã đề cập ở trên, độ tương phản giao thoa vi sai hoạt động bằng cách đặt một cặp lăng kính Nomarski đối lập nhau giữa các bản phân cực chéo nhau, sao cho bất kỳ kính hiển vi nào được trang bị cho quan sát DIC cũng có thể được sử dụng để kiểm tra mẫu vật trong ánh sáng phân cực phẳng chỉ bằng cách loại bỏ các lăng kính khỏi đường dẫn quang học. .
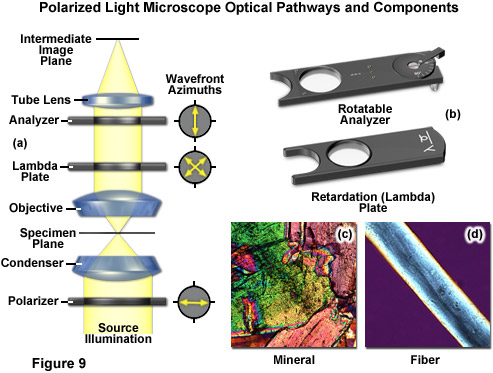
Sự sắp xếp thích hợp để chụp ảnh ánh sáng phân cực tương đối dễ thực hiện trên hầu hết mọi kính hiển vi. Bộ phân cực bên dưới tụ điện (gần màng chắn khẩu độ) đảm bảo rằng mẫu được chiếu sáng bằng các mặt sóng phân cực tuyến tính đi qua tụ quang (tham khảo Hình 9(a)). Máy phân tích (bộ phân cực thứ hai), được định hướng với góc phương vị được bố trí một góc 90 độ so với góc phương vị của bộ phân cực, được đặt phía sau vật kính. Thấu kính dạng ống tạo thành hình ảnh trung gian, được chiếu qua thị kính hoặc lên mặt phẳng tạo ảnh của máy ảnh. Nếu không có mẫu vật nào được đặt lên giá đỡ kính hiển vi, khung quan sát được qua thị kính sẽ hoàn toàn tối. Khi được chiếu sáng, nhiều mẫu vật chuyển hướng rung động của ánh sáng phân cực ra khỏi mặt phẳng do bản phân cực tạo ra. Những mẫu như vậy chủ yếu bao gồm các vật liệu lưỡng chiết, trong đó chiết suất phụ thuộc vào hướng dao động của ánh sáng tới. Điều này chủ yếu xảy ra với các tinh thể, chẳng hạn như tinh bột hoặc khoáng chất (Hình 9(c)), nhưng cũng xảy ra với sợi (Hình 9(d)) và polyme. Nếu những vật liệu như vậy được quan sát dưới kính hiển vi phân cực giữa bản phân cực chéo và máy phân tích, có thể nhìn thấy các vùng sáng trong ảnh vì ánh sáng được truyền đi một phần bởi máy phân tích.
Hệ quang học của kính hiển vi ánh sáng phân cực cũng có thể bao gồm một phần tử phụ được gọi là tấm lambda hoặc tấm chậm pha (Hình 9(a) và 9(b)), được sử dụng trong phân tích định lượng. Trong ánh sáng phân cực, tấm lambda này chuyển đổi độ tương phản thành các màu sắc. Tương tự như trong tương phản pha, sự khác biệt về đường quang học tạo ra màu sắc, mặc dù lần này là với ánh sáng phân cực và vật liệu lưỡng chiết trong mẫu vật. Những khác biệt về đường quang học này dẫn đến sự dập tắt của các bước sóng nhất định trong ánh sáng thông qua giao thoa (chỉ còn lại một số màu sắc nhất định từ ánh sáng trắng và tạo ra những hình ảnh màu sắc đẹp mắt). Kính hiển vi phân cực cung cấp một lượng thông tin lớn về thành phần và cấu trúc ba chiều của một loạt các mẫu vật. Với phạm vi gần như không giới hạn, kỹ thuật này có thể tiết lộ thông tin về lịch sử nhiệt và các biến dạng mà một mẫu vật phải chịu trong quá trình hình thành. Có giá trị trong sản xuất và nghiên cứu, kính hiển vi phân cực tương đối rẻ và là một công cụ nghiên cứu và kiểm soát chất lượng dễ tiếp cận, có thể cung cấp thông tin không thể có được bằng bất kỳ kỹ thuật nào khác
Nguồn: https://zeiss-campus.magnet.fsu.edu/articles/basics/contrast.html



 EN
EN