Giới thiệu
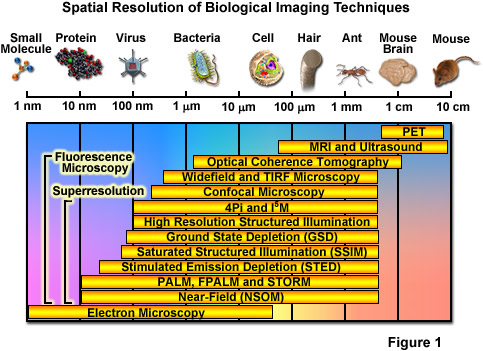
Trong nhiều thập kỷ qua, kính hiển vi huỳnh quang đã trở thành một công cụ thiết yếu để kiểm tra nhiều loại phân tử sinh học, con đường và động lực học trong tế bào sống, mô và toàn bộ động vật. Ngược lại với các kỹ thuật khác (chẳng hạn như kính hiển vi điện tử), hình ảnh huỳnh quang tương thích với các tế bào đang được nuôi cấy, cho phép quan sát dựa trên quang học ở mức độ xâm lấn tối thiểu các sự kiện xảy ra trong một khoảng thời gian lớn. Về độ phân giải không gian, một số kỹ thuật bao gồm chụp cắt lớp phát xạ positron, chụp cộng hưởng từ và chụp cắt lớp kết hợp quang học có thể tạo ra hình ảnh của đối tượng động vật và con người ở độ phân giải từ 10 cm đến 10 micromet, trong khi kính hiển vi điện tử và kỹ thuật thăm dò quét có tính năng quét không gian cao nhất. độ phân giải, thường đạt tới mức độ phân tử và nguyên tử (xem Hình 1). Giữa hai thái cực này về khả năng phân giải là kính hiển vi quang học. Bên cạnh những lợi ích thu được từ việc có thể chụp ảnh các tế bào sống, nhược điểm đáng kể nhất đối với tất cả các dạng kính hiển vi huỳnh quang (bao gồm trường rộng, quét laser, đĩa quay, đa photon và phản xạ nội toàn phần) là các giới hạn đối với độ phân giải không gian lần đầu tiên được làm sáng tỏ và được Ernst Abbe mô tả vào cuối những năm 1800.
Độ phân giải x,y = λ / 2[η • sin(α)] (1) Độ phân giải z = 2λ / [η • sin(α)] 2 (2)
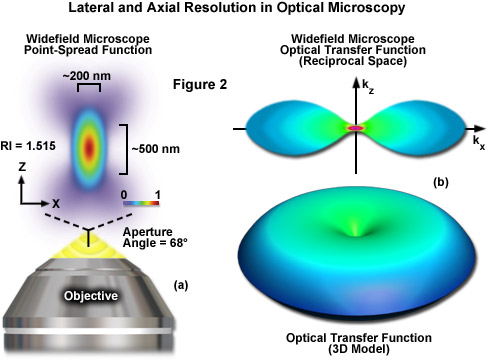
trong đó λ là bước sóng ánh sáng (kích thích trong huỳnh quang), η đại diện cho chiết suất của môi trường tạo ảnh và thuật ngữ kết hợp η • sin(α) được gọi là khẩu độ số vật kính (NA). Các vật kính thường được sử dụng trong kính hiển vi có khẩu độ số nhỏ hơn 1,5, giới hạn số hạng α trong các phương trình (1) và (2) ở mức nhỏ hơn 70 độ (mặc dù các vật kính hiệu suất cao mới tiến gần đến giới hạn này). Do đó, giới hạn độ phân giải lý thuyết ở bước sóng kích thích thực tế ngắn nhất (khoảng 400 nanomet) là khoảng 150 nanomet ở chiều bên và đạt gần 400 nanomet ở chiều trục khi sử dụng vật kính có khẩu độ số 1,40. Trong điều kiện thực tế để chụp ảnh protein huỳnh quang xanh tăng cường (EGFP) trong tế bào sống, các giá trị này lần lượt là khoảng 200 và 500 nanomet (xem Hình 2(a)). Do đó, các cấu trúc nằm gần hơn 200 nanomet không thể được phân giải trong mặt phẳng bên bằng kính hiển vi huỳnh quang trường rộng hoặc đồng tiêu.
Giới hạn nhiễu xạ Abbe đã tồn tại gần một thế kỷ trước khi các nhà cung cấp kính hiển vi bắt đầu kiểm tra xem dụng cụ của họ có thể được cải tiến như thế nào để vượt qua các rào cản vật lý nhằm đạt được độ phân giải cao hơn. Do thực tế là độ phân giải trục thấp hơn nhiều so với độ phân giải ngang (ít nhất là gấp đôi), phần lớn công việc được thực hiện vào nửa sau của thế kỷ 20 đề cập đến việc cải thiện hiệu suất theo chiều trục. Các nhà nghiên cứu đã phát hiện ra rằng các thiết bị quét laser đồng tiêu chỉ tạo ra sự gia tăng rất ít về độ phân giải với chi phí là tỷ lệ tín hiệu trên nhiễu, và rằng các công nghệ liên quan khác (bao gồm đa photon, chiếu sáng cấu trúc và đĩa quay) có thể được sử dụng để phân đoạn quang học, nhưng không cải thiện đáng kể độ phân giải trục
Một khái niệm quan trọng cần lưu ý, và một trong những thực tế bị đánh giá thấp nhất liên quan đến hình ảnh quang học trong sinh học, đó là độ phân giải đạt được của kính hiển vi thường không đạt đến giới hạn vật lý do nhiễu xạ gây ra. Điều này là do thực tế là sự không đồng nhất quang học trong mẫu vật có thể làm biến dạng pha của chùm tia kích thích, dẫn đến tiêu cự lớn hơn đáng kể so với tiêu cự lý tưởng bị giới hạn nhiễu xạ. Hơn nữa, độ phân giải cũng có thể bị ảnh hưởng do căn chỉnh kính hiển vi không đúng, sử dụng dầu ngâm không tương thích, lớp phủ có độ dày ngoài phạm vi tối ưu và vòng hiệu chỉnh được điều chỉnh không đúng.
Một khía cạnh quan trọng khác của giới hạn độ phân giải cơ bản trong kính hiển vi quang học được biểu hiện bằng phạm vi phần không triệt tiêu của hàm truyền quang của thiết bị (OTF), có thể được tính bằng cách sử dụng biến đổi Fourier của hàm trải rộng điểm. OTF xác định mức độ tần số không gian chứa thông tin về mẫu vật bị mất, giữ lại, suy giảm hoặc lệch pha trong quá trình chụp ảnh (Hình 2(b)). Thông tin tần số không gian bị mất trong quá trình chụp ảnh không thể phục hồi được, do đó một trong những mục tiêu chính của tất cả các dạng kính hiển vi là thu được dải tần số cao nhất có thể từ mẫu vật. Trong kính hiển vi huỳnh quang truyền thống, yêu cầu phổ biến để đạt được mục tiêu này là đảm bảo rằng huỳnh quang phát ra tỷ lệ tuyến tính với cường độ cục bộ của ánh sáng kích thích. Tuy nhiên, không giống như trường hợp ánh sáng truyền qua và ánh sáng phản xạ, sự phát xạ huỳnh quang là không kết hợp do băng thông phổ rộng và bản chất ngẫu nhiên của quá trình các electron trở về trạng thái năng lượng thấp hơn để tạo ra các photon thứ cấp.
Những tiến bộ đáng kể nhất trong hình ảnh siêu phân giải đã đạt được trong cái được gọi là kính hiển vi quét trường xa và liên quan đến việc điều chỉnh theo không gian hoặc thời gian sự chuyển đổi giữa hai trạng thái phân tử của chất huỳnh quang (chẳng hạn như chuyển đổi giữa trạng thái tối và sáng) hoặc bằng cách giảm vật lý kích thước của hàm trải rộng điểm được sử dụng trong chiếu sáng kích thích. Trong số các phương pháp cải thiện độ phân giải bằng cách sửa đổi PSF, các kỹ thuật quan trọng nhất được gọi bằng các từ viết tắt STED (sự suy giảm phát xạ kích thích; từ phòng thí nghiệm Stefan Hell) và SSIM (kính hiển vi chiếu sáng có cấu trúc bão hòa; do Mats Gustafsson tiên phong). Các kỹ thuật dựa vào việc phát hiện và định vị chính xác các phân tử đơn lẻ bao gồm PALM (kính hiển vi định vị quang hóa; được giới thiệu bởi Eric Betzig và Harald Hess) và STORM (kính hiển vi tái tạo quang học ngẫu nhiên; được báo cáo đầu tiên bởi Xiaowei Zhang). Như sẽ được thảo luận, có nhiều biến thể của các kỹ thuật này cũng như các phương pháp tiên tiến có thể kết hợp hoặc thậm chí cải thiện hiệu suất của các sơ đồ hình ảnh hiện có. Quan trọng hơn nữa, các kỹ thuật siêu phân giải mới đang được giới thiệu với tốc độ vượt trội (so với những tiến bộ truyền thống trong kính hiển vi) và không phải vô lý khi cho rằng tại một thời điểm nào đó trong tương lai gần, độ phân giải một nanomet có thể đạt được trong các thiết bị thương mại.
Kính hiển vi quang học quét trường gần
Trước khi thảo luận ngắn gọn về kỹ thuật kính hiển vi quang học quét trường gần (NSOM) có độ phân giải cao, điều quan trọng là phải phân biệt giữa các khái niệm trường gần và trường xa, được lấy từ lý thuyết bức xạ điện từ được phát triển cho công nghệ ăng-ten và áp dụng cho kính hiển vi. Có hai điểm khác biệt cơ bản giữa các khái niệm liên quan đến kích thước của vùng mẫu được chiếu sáng và khoảng cách tách biệt giữa nguồn bức xạ và mẫu, nhưng ranh giới giữa hai vùng chỉ được xác định một cách không rõ ràng. Trong kính hiển vi quét trường gần, mẫu vật được chụp trong vùng có bán kính ngắn hơn nhiều so với bước sóng chiếu sáng. Ngược lại, kính hiển vi quét trường xa định vị mẫu vật cách vật kính hàng nghìn bước sóng (thường là một milimet hoặc hơn) và bị giới hạn độ phân giải do nhiễu xạ của mặt sóng quang khi chúng đi qua khẩu độ phía sau vật kính. Hầu hết các kính hiển vi thông thường, bao gồm cả những kính hiển vi được sử dụng để chụp ảnh ánh sáng truyền qua (trường sáng, DIC và độ tương phản pha), huỳnh quang trường rộng, tiêu điểm và đa photon đều được coi là các thiết bị quét trường xa, giới hạn nhiễu xạ.
Kính hiển vi quét trường gần phá vỡ rào cản nhiễu xạ bằng cách khai thác các đặc tính độc đáo của sóng biến đổi. Trong thực tế, khẩu độ máy dò có kích thước nano được đặt liền kề với mẫu vật ở khoảng cách ngắn hơn nhiều so với bước sóng chiếu sáng để phát hiện các sóng ánh sáng không lan truyền được tạo ra trên bề mặt. Độ phân giải chỉ bị giới hạn bởi kích thước vật lý của khẩu độ chứ không phải là bước sóng của ánh sáng chiếu sáng, sao cho có thể đạt được độ phân giải ngang và dọc trục lần lượt là 20 nanomet và 2 đến 5 nanomet. Độ tương phản được tạo ra bởi chỉ số khúc xạ, cấu trúc hóa học, ứng suất cục bộ hoặc đặc tính phát xạ huỳnh quang của đầu dò được sử dụng để nhuộm mẫu vật. Tuy nhiên, đặc tính sóng biến mất của kỹ thuật hình ảnh này khiến ứng dụng kính hiển vi quét trường gần trong sinh học không được sử dụng để kiểm tra bề mặt tế bào thay vì thăm dò các sự kiện phức tạp trong tế bào chất. Những hạn chế tương tự cũng áp dụng cho kỹ thuật kính hiển vi quét đầu dò (chẳng hạn như lực nguyên tử).
Bởi vì chúng không yêu cầu huỳnh quang nên kỹ thuật kính hiển vi quét trường gần có khả năng chụp ảnh các vật liệu không phát xạ, chẳng hạn như bề mặt bán dẫn hoặc màng mỏng sử dụng các cơ chế tương phản liên quan đến tán xạ Raman, quang phổ, giao thoa, ánh sáng phân cực, hấp thụ hoặc một số loại khác. của tín hiệu quang. Độ phân giải nằm trong khoảng từ 2 đến 15 nanomet đã đạt được, tùy thuộc vào chất lượng đầu dò và cường độ trường xác định. Tuy nhiên, bề mặt của mẫu vật thay đổi dần dần (không bị lồi lõm) để tránh va chạm với đầu dò và có thể gây hư hỏng cho cả hai thực thể. Eric Betzig, người đồng phát minh ra PALM, đã thu được hình ảnh siêu phân giải đầu tiên của một mẫu sinh học vào năm 1992 bằng kính hiển vi quang học quét trường gần. Trong những năm gần đây, NSOM đã được sử dụng để nghiên cứu tổ chức ở cấp độ nano của một số protein màng, nhưng nhìn chung, phương pháp này gặp nhiều thách thức và như đã thảo luận ở trên, không phù hợp để chụp ảnh nội bào.
Cải thiện độ phân giải trục: Kính hiển vi I5M và 4Pi
Sự giao thoa giữa hai hoặc nhiều nguồn sáng kích thích có thể dẫn đến việc tạo ra kiểu chiếu sáng định kỳ trong mặt phẳng mẫu. Sự tương tác của mẫu này với cấu trúc phụ chi tiết tinh xảo của mẫu huỳnh quang tạo ra sự phát xạ có chứa thông tin có độ phân giải cao hơn so với kỹ thuật chiếu sáng kính hiển vi thông thường. Ngoài ra, có thể đạt được hiệu ứng phân giải tương tự khi phát xạ huỳnh quang được thu thập bởi các vật kính kép và kết hợp để gây nhiễu trên mặt phẳng hình ảnh của camera. Do đó, trong hầu hết các trường hợp, cấu hình kính hiển vi giao thoa kết hợp hai vật kính đối lập nhau được đặt ở mỗi bên của mẫu vật (được kẹp giữa các tấm kính mỏng; xem Hình 3(a)). Việc sử dụng hai vật kính làm tăng khẩu độ số (mở rộng góc khối khẩu độ) của kính hiển vi để tạo ra độ phân giải được cải thiện. Trong trường hợp lý tưởng, việc sử dụng hai vật kính sẽ dẫn đến hàm trải rộng điểm đối xứng theo chiều trục và chiều ngang. Mặc dù những cái tên gợi ý sự đối xứng tối ưu trong hàm trải rộng điểm (một quả cầu đầy đủ có góc đặc bằng 4π), các kỹ thuật giao thoa và kính hiển vi 4Pi được thảo luận dưới đây tiếp cận nhưng không hoàn toàn đạt được hình học này. Ngoài ra, do chất lượng của mẫu giao thoa bị gián đoạn khi di chuyển qua các mô dày nên các kỹ thuật này thường bị hạn chế sử dụng với các mẫu vật mỏng, chẳng hạn như tế bào bám dính.
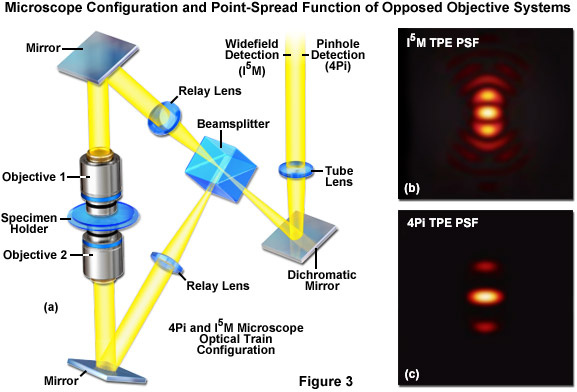
Trong một cải tiến liên quan đến kính hiển vi huỳnh quang sóng đứng (SWFM), kỹ thuật tiên tiến hơn của I3M sử dụng sự chiếu sáng qua cả hai vật kính để tạo ra các mẫu kích thích chứa các nút và phản nút trong mặt phẳng tiêu cự nơi các chùm tia có thể giao thoa tăng cường. Do thực tế là mẫu được chiếu sáng đồng đều trên toàn bộ trường nhìn, nhưng sự kích thích bị hạn chế ở các phần phụ trục, chỉ có độ phân giải trục được cải thiện. Sự kết hợp của các kỹ thuật can thiệp hình ảnh được mô tả ở trên được gọi là I5M có khả năng đạt được độ phân giải trục tốt hơn gấp ba lần ở chế độ hình ảnh đồng tiêu và tốt hơn gấp bảy lần ở chế độ hình ảnh trường rộng. Bởi vì tất cả các hình ảnh được thu thập từ một trường nhìn rộng, việc thu thập dữ liệu trên mỗi khung hình nhanh hơn nhiều so với các kỹ thuật quét điểm đồng tâm thông thường. Tuy nhiên, để duy trì tần số lấy mẫu theo tiêu chí Nyquist (hai phép đo trên mỗi đơn vị độ phân giải), các phần quang trục phải được ghi lại ở các khoảng cách từ 35 đến 45 nanomet. Do đó, việc thu thập ngăn xếp phần quang học vẫn có thể cần vài phút. Các thùy bên lớn được tạo ra trong kính hiển vi I5M (như trong Hình 3(b)) đã hạn chế kỹ thuật này chỉ sử dụng với các tế bào cố định vì môi trường gắn chiết suất cao là cần thiết để chụp ảnh.
Kỹ thuật có độ phân giải tương đối cao của kính hiển vi 4Pi cũng tận dụng các vật kính đối lập nhau, nhưng không giống như I5M, sự hội tụ của ánh sáng kích thích bằng laser tạo ra các mặt sóng được tổng hợp mạch lạc tại một tiêu điểm chung thay vì toàn bộ mặt phẳng tiêu điểm. Trong một số triển khai kính hiển vi 4Pi, các mặt sóng hình cầu của phát xạ huỳnh quang được tổng hợp một cách mạch lạc tại máy dò. Kết quả là, sự giao thoa tăng cường của mặt sóng làm tăng độ phân giải dọc trục lên khoảng 100 nanomet và tạo ra hàm trải rộng điểm hẹp hơn 1,5 lần so với kính hiển vi đồng tiêu ở các chiều bên và thấp hơn bảy lần theo hướng trục. Tuy nhiên, do thực tế là mặt sóng mở rộng vẫn chưa có dạng hình cầu hoàn toàn nên tiêu điểm có các thùy theo chiều trục phía trên và bên dưới mặt phẳng tiêu điểm. Do đó, kính hiển vi 4Pi thường được sử dụng với sự kích thích hai photon, làm giảm tín hiệu thùy do hiệu ứng bình phương (Hình 3(c)). Việc giải mã toán học của dữ liệu hình ảnh thô là bắt buộc hoặc tùy chọn, tùy thuộc vào cấu hình kính hiển vi.
Khái niệm về độ phân giải
Nền tảng lý thuyết cần thiết để đạt được độ phân giải bên dưới hàng rào nhiễu xạ, thực tế bao gồm một nhóm các khái niệm vật lý, lần đầu tiên được phát triển bởi Stefan Hell và cộng sự với việc họ đưa ra ý tưởng về sự chuyển đổi huỳnh quang quang học bão hòa (hoặc có thể chuyển đổi) thuận nghịch (RESOLFT) . Sơ đồ này tập trung vào các đầu dò huỳnh quang có thể được chuyển đổi quang học thuận nghịch giữa trạng thái “bật” huỳnh quang và trạng thái “tắt” tối (hoặc giữa hai trạng thái A và B bất kỳ ). Bản chất chính xác của các trạng thái này có thể thay đổi và có thể là trạng thái cơ bản và trạng thái đơn lẻ bị kích thích ( S0 và S1 ) của fluorophore như sẽ được thảo luận dưới đây đối với kính hiển vi STED, trạng thái đơn lẻ bị kích thích và trạng thái bộ ba tối được sử dụng trong sự suy giảm trạng thái cơ bản (GSD) và kính hiển vi GSDIM, hoặc trạng thái sáng và tối của chất fluorophore có khả năng chuyển đổi quang học thuận nghịch (như Cy5, protein huỳnh quang mồi hoặc Dronpa). Ngược lại, nhiều protein huỳnh quang đánh dấu quang học, chẳng hạn như Eos, Kaede, Dendra2 và PA-GFP, có khả năng chuyển đổi quang học vĩnh viễn từ băng thông phát xạ này sang băng thông phát xạ khác thông qua các thay đổi phân tử cộng hóa trị đối với khung polypeptide (và đóng vai trò là nền tảng cho các thí nghiệm PALM đầu tiên), không phải là đầu dò thích hợp cho RESOLFT vì những thay đổi trong trạng thái huỳnh quang là không thể đảo ngược. Khái niệm RESOLFT cũng bao gồm các trạng thái chuyển đổi đồng phân hóa (chẳng hạn như cis – trans ) và các chuyển tiếp ổn định quang học khác trong fluorophores.
Đối với bất kỳ loại đầu dò huỳnh quang hoặc loại đầu dò huỳnh quang nhất định nào, số lượng trạng thái có thể chuyển đổi bị giới hạn nghiêm ngặt, do đó không có gì đáng ngạc nhiên khi nhiều kỹ thuật siêu phân giải phân tử đơn và RESOLFT được mô tả dưới đây đều dựa vào các cơ chế chuyển đổi fluorophore tương tự. Để hiểu rõ hơn những đặc tính chung này, việc xem xét kỹ lưỡng các nguyên tắc cơ bản đằng sau các chuyển đổi quang học được điều khiển không mạch lạc là rất hữu ích. Khi một phân tử chuyển đổi quang học từ trạng thái này sang trạng thái khác, xác suất phân tử đó vẫn ở trạng thái đầu tiên sẽ giảm theo cấp số nhân khi cường độ ánh sáng kích thích tăng lên. Thuật ngữ cường độ bão hòa được sử dụng để xác định cường độ ánh sáng tại đó xảy ra quá trình chuyển đổi chuyển mạch (ví dụ: khi 50% phân tử chuyển từ tối sang sáng) và tỷ lệ nghịch với thời gian tồn tại của hai trạng thái. Trong trường hợp cường độ ánh sáng kích thích vượt quá cường độ bão hòa, rất có khả năng một trong các photon tới sẽ bắt đầu quá trình chuyển đổi quang học. Các tế bào huỳnh quang có tuổi thọ dài ở trạng thái chuyển đổi ban đầu và cuối cùng sẽ có nhiều khả năng lựa chọn cường độ kích thích hơn và thường thể hiện mức độ bền mỏi cao hơn (thước đo khả năng chuyển đổi quang học nhiều lần trước khi bị phá hủy). Các đầu dò huỳnh quang khác nhau được sử dụng cho kính hiển vi siêu phân giải có tuổi thọ khác nhau đáng kể, cũng như cường độ bão hòa cần thiết để thực hiện chuyển đổi ảnh.
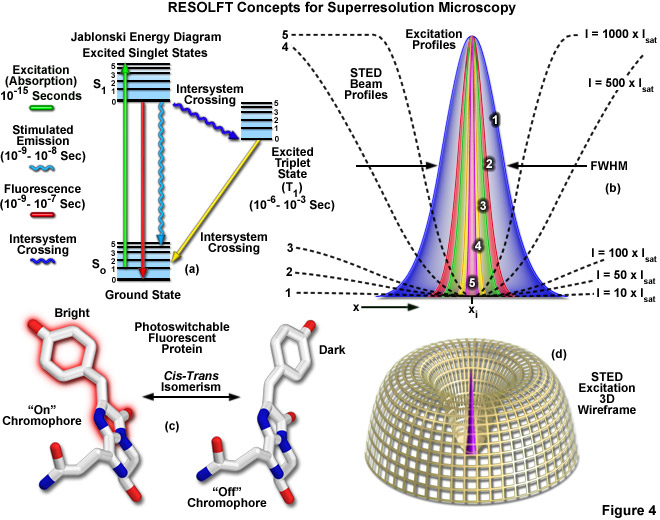
Được trình bày trong Hình 4 là một số khái niệm quan trọng nhất xung quanh hình ảnh siêu phân giải sử dụng kỹ thuật RESOLFT. Sơ đồ năng lượng Jablonski đơn giản hóa (Hình 4(a)) mô tả các trạng thái kích thích và nền điện tử có thể có liên quan đến các chuyển đổi quang thuận nghịch bật tắt, chẳng hạn như đồng phân cis – trans liên kết với các protein huỳnh quang có thể chuyển đổi quang (như minh họa trong Hình 4( c) đối với protein huỳnh quang Kindling). Cấu hình laser suy giảm 1-5 trong Hình 4(b) làm nổi bật vùng không gian trong đó chất huỳnh quang tồn tại ở trạng thái A (hoặc trạng thái “bật”) trong các vùng mà sóng đứng của ánh sáng suy giảm biểu hiện cường độ từ 10 (cấu hình 1) đến 1000 (cấu hình 5) lần cường độ bão hòa (như được nêu trong Phương trình (3)) và nút 0 tại xi . Khi cường độ laser suy giảm tăng lên, vùng nơi chất huỳnh quang có khả năng cư trú ở trạng thái A sẽ giảm đi để tạo ra sự gia tăng độ phân giải ngang sau đó. Biểu diễn khung dây ba chiều (Hình 4(d)) của cấu hình tia laser diệt phát quang và kích thích minh họa việc sửa đổi chức năng trải rộng điểm bằng kỹ thuật RESOLFT.
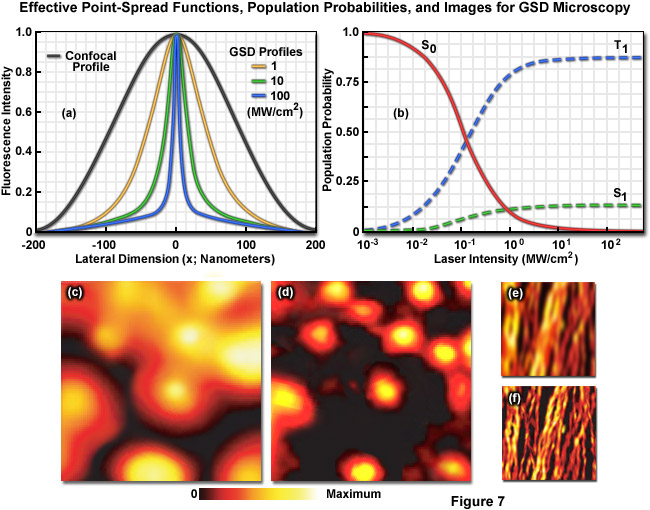
Quá trình chuyển đổi ảnh có mục tiêu của RESOLFT (như được tổng quát hóa cho STED và GSD) được thực hiện bằng cách kiểm soát không gian sự phân bố cường độ ánh sáng của tia laser diệt phát quang để chỉ có thể bật một số lượng hạn chế các phân tử trong khi phần lớn các phân tử khác vẫn ở trạng thái tắt. Do đó, khi một bước sóng cụ thể có cường độ xác định (cao hơn nhiều so với cường độ bão hòa) được chọn để tắt fluorophore, thì việc áp dụng ánh sáng này theo cách điều chế không gian được sử dụng để hạn chế các fluorophores còn lại ở trạng thái bật ở mức đột ngột. vùng xác định. Do đó, độ phân giải (toàn bộ chiều rộng ở mức tối đa một nửa; FWHM ) cho hàm trải rộng điểm sử dụng các kỹ thuật này được xác định theo phương trình sau:
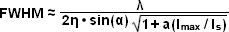 Phương trình (3)
Phương trình (3)
trong đó λ là bước sóng của ánh sáng kích thích và số hạng kết hợp η • sin(α) là khẩu độ số vật kính, như được mô tả ở trên đối với công thức Abbe cổ điển (Phương trình (1)). Biến a là tham số xét đến hình dạng của chùm tia laser suy giảm được điều chế theo không gian, thường được biểu hiện ở dạng đường thẳng hoặc hình “doughnut” có nút 0 ở giữa (xem Hình 4(b)). Dưới căn bậc hai, Imax là cường độ cực đại của tia laser suy giảm và Is là cường độ bão hòa của fluorophore được chụp ảnh. Trong trường hợp Imax bằng 0, Phương trình (3) giảm xuống giới hạn nhiễu xạ Abbe. Ngược lại, khi Imax lớn hơn nhiều so với cường độ bão hòa fluorophore (trong thực tế, giá trị của căn bậc hai tăng), hàm trải rộng điểm trở nên rất hẹp và đạt được siêu phân giải. Ví dụ: khi Imax / Is bằng 100, độ phân giải được cải thiện gấp khoảng 10 lần. Do đó, phù hợp với lý thuyết, độ phân giải nhiễu xạ phụ bên dưới giới hạn Abbe tỷ lệ với căn bậc hai của cường độ ánh sáng làm suy giảm trạng thái cơ bản. Độ phân giải của tất cả các phương pháp dựa vào kết quả đọc mục tiêu của đầu dò huỳnh quang, bao gồm RESOLFT, STED, GSD và SSIM, được điều chỉnh bởi Phương trình (3) bất kể cơ chế chuyển mạch fluorophore hay các tham số hình học điều chế không gian được quy định bởi cấu hình kính hiển vi
Kỹ thuật RESOLFT yêu cầu quét mẫu bằng nút 0 trong trường của tia laser diệt phát quang, nhưng không nhất thiết phải sử dụng một chùm tia hoặc vùng 0 bị giới hạn về mặt hình học ở một điểm. Nhiều vạch tối hoặc số 0 cũng có thể được sử dụng cùng với máy dò camera kỹ thuật số mảng vùng (CCD) thông thường, miễn là các số 0 hoặc vạch tối cách nhau xa hơn khoảng cách tối thiểu theo yêu cầu của giới hạn độ phân giải nhiễu xạ. Chỉ quét với các vạch tối sẽ tăng độ phân giải theo một hướng bên, nhưng việc quét lặp lại sau khi xoay mẫu theo sau là giải mã toán học có thể cung cấp độ phân giải phụ nhiễu xạ trên trục bên. Yêu cầu cơ bản để quét mẫu vật là lý do tại sao các chuyển tiếp RESOLFT (A/B hoặc bật/tắt) phải có thể đảo ngược được. Các phân tử ở một trạng thái phải có khả năng trở lại trạng thái khác khi chúng được quét bởi nút 0. Lưu ý rằng sự suy giảm bão hòa của các phân tử ở trạng thái kích thích sử dụng tiêu điểm nút 0 tạo ra hàm trải rộng điểm siêu phân giải không bị giới hạn bởi bước sóng mà chỉ bị giới hạn bởi cường độ của laser diệt phát quang.
Được trình bày trong Hình 5 là các hình ảnh có độ phân giải cao của các hạt huỳnh quang 50 nanomet cùng với cấu hình cường độ được tạo ra bởi một lớp thuốc nhuộm huỳnh quang đồng nhất được chiếu sáng bằng chùm tia Gaussian được điều chế theo mô hình đường trong kính hiển vi chiếu sáng có cấu trúc bão hòa. Trong kính hiển vi trường rộng, các hạt huỳnh quang có độ phân giải kém (Hình 5(a)) và xuất hiện dưới dạng khối mờ. Lọc toán học của hình ảnh trường rộng (Hình 5(b)) tạo ra sự cải thiện ít, nhưng chiếu sáng có cấu trúc tuyến tính (Hình 5(c)) mang lại độ phân giải cao hơn. Sự gia tăng đáng kể nhất về độ phân giải ngang đạt được với SSIM (Hình 5(d)) sử dụng ba bậc hài hòa (Hình 5(e) và (f)) trong quá trình xử lý hình ảnh. Cấu hình cường độ thông qua hình ảnh của lớp thuốc nhuộm huỳnh quang mỏng có chu kỳ điều chế 2,5 micromet được thể hiện trong Hình 5(e) ở mật độ năng lượng cực đại cao (đường cong màu đỏ) và thấp (đường cong màu vàng). Đường cong phía dưới bám sát mô hình chiếu sáng hình sin vì mật độ năng lượng cực đại nằm dưới giới hạn bão hòa. Ở đường cong trên cùng, năng lượng xung cao hơn sẽ tạo ra huỳnh quang bão hòa gần các đỉnh. Các phép biến đổi Fourier (Hình 5(f)) tương ứng với các kiểu chiếu sáng trong Hình 5(e) thể hiện một số sóng hài được tạo ra bởi tính phi tuyến tính của cường độ chiếu sáng bão hòa (đường cong màu đỏ), trong khi chỉ có thể phát hiện được sóng hài thấp nhất ở mức thấp hơn mô hình năng lượng (đường cong màu vàng).
Sự kích thích mạnh mẽ cần thiết cho nhiều kỹ thuật RESOLFT bị ảnh hưởng bởi thực tế là cường độ laser cao thường tạo ra tốc độ tẩy quang quá cao nên chất fluorophores phải được lựa chọn cẩn thận. Do đó, mặc dù nhóm phương pháp RESOLFT không phụ thuộc vào rào cản nhiễu xạ truyền thống, nhưng sự phụ thuộc của cường độ laser vào độ phân giải sẽ tạo ra một rào cản khác bị chi phối bởi mức năng lượng laser mà fluorophore có thể chịu được. Biện pháp khắc phục tốt nhất cho vấn đề nan giải này là loại bỏ sự cần thiết của cường độ mạnh bằng cách thực hiện các chuyển đổi phân tử xảy ra với công suất laser diệt phát quang thấp. Nhiều đầu dò huỳnh quang bền vững đáp ứng tiêu chí này và có thể chuyển đổi quang học giữa trạng thái huỳnh quang và không huỳnh quang thông qua các cơ chế năng lượng thấp như đồng phân hóa cis – trans cảm ứng quang (Hình 4(c)). Trong trường hợp cả hai trạng thái đều ổn định, quá trình chuyển đổi quang học qua lại giữa các trạng thái có thể được hoàn thành ở các thang thời gian rất dài hoặc tùy ý, cho phép ánh sáng được trải đều theo thời gian và giảm cường độ cần thiết (cũng như quá trình tẩy trắng quang học). hiện vật) theo nhiều bậc độ lớn. Chiến lược như vậy đã cho phép song song hóa các phương pháp RESOLFT để cho phép sử dụng chúng trong chụp ảnh trường rộng trên diện rộng. Lưu ý rằng như được mô tả ở trên, một trong những ý tưởng chính đằng sau RESOLFT là hình ảnh siêu phân giải không nhất thiết yêu cầu cường độ ánh sáng cực cao.
Siêu phân giải của PSF Engineering
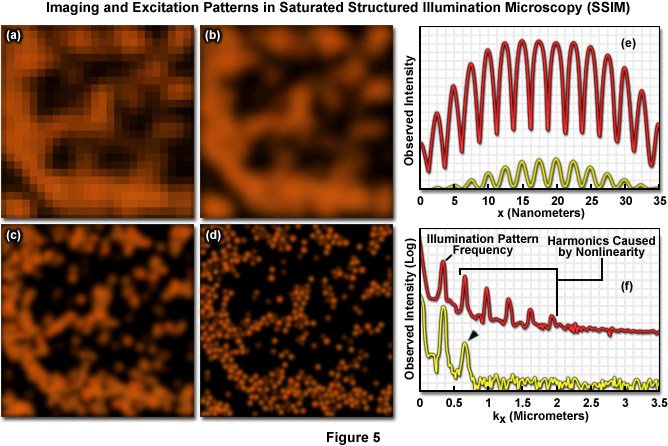
Các kỹ thuật kỹ thuật trải rộng điểm được thiết kế để phá vỡ rào cản nhiễu xạ đều dựa vào kết quả đọc tuần tự theo thời gian của quá trình chuyển đổi ảnh của đầu dò huỳnh quang. Kỹ thuật đầu tiên được áp dụng thành công để chụp ảnh sinh học siêu phân giải của các tế bào cố định là phương pháp RESOLFT có tên là suy giảm phát xạ kích thích (STED). Như đã thảo luận ở trên, STED sử dụng các chuyển đổi bão hòa và được điều chế theo không gian giữa hai trạng thái phân tử để cải tiến kỹ thuật cho chức năng trải rộng điểm. Trong kính hiển vi STED, mẫu vật được chiếu sáng bởi hai nguồn đồng tuyến cực nhanh được đồng bộ hóa bao gồm một xung laser kích thích, theo sau là xung laser diệt phát quang dịch chuyển đỏ được gọi là chùm STED (xem Hình 6). Nói chung, độ rộng xung laser kích thích có thời gian ngắn hơn so với xung STED (mặc dù cả hai thường nằm trong phạm vi từ 10 đến 300 pico giây). Laser xung tận dụng thang thời gian để thư giãn phân tử và giao thoa ánh sáng kết hợp để tạo ra các vùng suy giảm đối xứng xuyên tâm. Các chất huỳnh quang được định vị trong vùng nút 0 của chùm STED được phép phát huỳnh quang khi tiếp xúc với chùm tia kích thích, trong khi các chất huỳnh quang tiếp xúc với chùm STED được chuyển trở lại trạng thái cơ bản (không huỳnh quang) bằng phát xạ kích thích (Hình 6 (b)). Sự suy giảm phi tuyến tính (theo đường cong hàm mũ) của trạng thái huỳnh quang bị kích thích bởi chùm STED tạo thành cơ sở cho việc chụp ảnh ở độ phân giải nằm dưới hàng rào nhiễu xạ.
STED tận dụng khái niệm RESOLFT bằng cách sửa đổi đáng kể hình dạng của Hàm phân phối điểm kích thích (excitation point-spread function) có thể được điều chỉnh bằng cách thay đổi pha, độ rộng xung, và cường độ của các laser kích thích và tia laser diệt phát quang. Mặc dù cả hai tia laser vẫn bị giới hạn nhiễu xạ khi chùm tia của chúng đi qua dãy quang học của kính hiển vi, nhưng xung STED được biến đổi bằng bộ điều biến pha để tạo ra một nút cường độ bằng 0 ở tâm tiêu điểm với cường độ tăng theo cấp số nhân về phía ngoại vi. Cấu hình này tạo ra chùm tia hình doughnut bao quanh tiêu điểm trung tâm (và chức năng trải rộng điểm) của laser kích thích. Chỉ tại tâm điểm chính xác (nút) thì cường độ của chùm STED mới bằng 0 (Hình 6(b)). Bước sóng và thời lượng của xung chùm STED được chọn tương ứng với cường độ phát xạ cực đại và cường độ bão hòa của fluorophore đang được nghiên cứu. Việc tắt các chất huỳnh quang xảy ra trong toàn bộ tiêu điểm ngoại trừ ở trung tâm của tiêu điểm. Ở mức năng lượng laser diệt phát quang cao được sử dụng cho STED (thường vượt quá 250 megawatt trên centimet vuông), các fluorophores gần như ngay lập tức được đưa về trạng thái cơ bản bằng sự phát xạ kích thích. Việc giảm đáng kể công suất laser (như được thảo luận dưới đây) cho phép hình thành trạng thái không phát huỳnh quang thông qua một số cơ chế khác, bao gồm đưa các fluorophores vào trạng thái bộ ba siêu bền, hình thành các trạng thái truyền điện tích hoặc chuyển đổi quang học.
Trường sóng laser diệt phát quang hình doughnut trong STED thu hẹp một cách hiệu quả chức năng trải rộng điểm của laser kích thích để tăng độ phân giải vượt quá giới hạn nhiễu xạ, trong trường hợp tốt nhất có thể đạt tới 20 nanomet ở chiều bên. Do đó, việc làm sắc nét tiêu điểm thông qua kỹ thuật chức năng trải rộng điểm tương đương với việc mở rộng băng thông tần số không gian của kính hiển vi. Để có được hình ảnh hoàn chỉnh, điểm 0 trung tâm do laser STED tạo ra sẽ được quét raster trên mẫu vật, tương tự như hoạt động của kính hiển vi đồng tiêu. Một trong những lợi ích của kính hiển vi STED là việc tăng độ phân giải hiệu quả hoàn toàn được quyết định bởi cấu hình thử nghiệm và công suất laser tác dụng lên mẫu vật. Hơn nữa, hình ảnh được ghi lại khi chùm tia quét dọc theo mẫu vật và không cần xử lý thêm, đồng thời thời gian thu nhận hình ảnh có thể đạt tốc độ của bất kỳ kính hiển vi đồng tiêu quét laser nào. Việc tăng độ phân giải hiệu quả với STED tỷ lệ thuận với công suất của tia laser diệt phát quang, nhưng có thể trở thành vấn đề ở công suất laser cực cao có khả năng dẫn đến hiện tượng tẩy quang nhanh và phá hủy đầu dò. Bất chấp điều đó, nhiều loại fluorophores đã được sử dụng thành công với STED (xem Bảng 1), bao gồm protein huỳnh quang, thuốc nhuộm ATTO, Alexa Fluors, DyLights và một số chất tổng hợp khác.
Các phiên bản nâng cao của STED đã được triển khai để giải quyết các cải tiến về độ phân giải dọc trục cho hình ảnh siêu phân giải ba chiều của các quần thể. Bằng cách ghép hai tia laser diệt phát quang STED với cấu hình kiểu mục tiêu đối lập 4Pi, Stefan Hell và các cộng sự đã thành công trong việc tạo ra độ phân giải được cải thiện đáng kể ở cả chiều ngang và chiều trục. Kỹ thuật này được gọi là iso-STED do thực tế là nó mang lại hàm trải rộng điểm gần như đẳng hướng (hình cầu) có thể điều chỉnh được với độ phân giải đạt tới 40 nanomet dọc theo trục. Một tiêu điểm đối xứng như vậy sẽ tỏ ra có lợi trong việc thu được các phần quang học có độ phân giải cao từ sâu bên trong các tế bào và mô sinh học. Cấu hình thiết bị phức tạp bao gồm các tia laser STED kép được kết hợp và gửi đến cả hai mục tiêu bằng bộ tách chùm. Ngoài ra, xử lý hình ảnh kỹ thuật số có thể được sử dụng để giảm hiệu ứng của các búp bên và các thành phần giả khác làm ảnh hưởng đến chức năng trải rộng điểm. Một thiết bị STED nhỏ gọn hơn và đơn giản hơn dựa trên nguồn laser siêu liên tục đã được thiết kế để chụp ảnh ba chiều bằng cách sử dụng một thấu kính duy nhất để thu thập các phần quang học ở độ phân giải ngang 45 nanomet và độ phân giải trục khoảng 100 nanomet.
Đặc tính của đầu dò huỳnh quang được chọn cho kính hiển vi STED
| Huỳnh quang | Ex λ (nm) |
Độ rộng xung (pico giây) |
STED λ (nm) |
Độ rộng xung (pico giây) |
Độ phân giải (lateral; nm) |
| Thuốc nhuộm tổng hợp | |||||
| ATTO 425 | 440 | 130 | 532 | 1000 | 70-80 |
| ATTO 565 | 532 | 90 | 640 | 90 | 30-40 |
| ATTO 663 | 635 | 100 | 750 | 200 | 40 |
| Alexa Fluor 594 | 570 | 90 | 700 | 90 | 60 |
| DyLight 594 | 570 | 90 | 700 | 90 | 60 |
| RH 414 | 554 | 0,25 | 745 | 13 | 30 |
| Protein huỳnh quang | |||||
| EGFP | 490 | 100 | 575 | 200 | 70 |
| Citrine | 490 | 100 | 598 | 300 | 50 |
| EYFP | 490 | 100 | 598 | 300 | 70 |
Bảng 1
Các nguyên tắc RESOLFT tương tự được mô tả ở trên đối với kính hiển vi STED cũng áp dụng cho kính hiển vi suy giảm trạng thái cơ bản (GSD), trong đó đầu dò huỳnh quang cũng được chuyển đổi quang học sang trạng thái tắt bằng cách sử dụng tia laser có nút 0 ở giữa. Trong GSD, cơ chế chuyển đổi ảnh liên quan đến việc tạm thời xếp fluorophore vào trạng thái bộ ba tối siêu bền (T1). Sự chuyển đổi điện tử sang mức năng lượng siêu bền thường bị “hạn chế” bởi các quy tắc lựa chọn lưỡng cực điện do yêu cầu lật spin, nghĩa là chúng chỉ xảy ra với xác suất rất thấp. Bất chấp điều đó, trạng thái bộ ba có thể được tạo ra bằng cách kích thích lặp đi lặp lại fluorophore đến trạng thái bộ đơn bị kích thích đầu tiên ( S 1 ) để tăng khả năng xảy ra giao thoa hệ thống không bức xạ từ S1 đến T1 . Các electron vẫn ở trạng thái siêu bền trong khoảng thời gian tương đối dài, có thể dao động từ micro giây đến mili giây. Công suất laser diệt phát quang cần thiết để đưa các chất huỳnh quang vào trạng thái bộ ba (thường là vài kilowatt trên mỗi centimet bình phương) thấp hơn đáng kể so với công suất cần thiết cho kính hiển vi STED.
Một trong những thách thức lớn nhất khi thực hiện kính hiển vi GSD là lựa chọn đầu dò huỳnh quang phù hợp do có khả năng liên quan đến trạng thái tối huỳnh quang trong quá trình tẩy quang. Ngoài ra, những fluorophores có thể được điều khiển một cách hiệu quả đến trạng thái bộ ba phải có khả năng phục hồi sau khi loại bỏ tia laser diệt phát quang Phục hồi huỳnh quang là nhiệm vụ quan trọng vì GSD dựa vào việc quét mẫu vật theo cách tương tự như kính hiển vi đồng tiêu và STED. Nói tóm lại, các fluorophores bị mắc kẹt ở trạng thái bộ ba phải có khả năng thư giãn về trạng thái cơ bản trước khi chùm tia suy giảm di chuyển đến vị trí không gian tiếp theo. Do đó, trong kính hiển vi GSD phải có sự cân bằng tinh tế giữa thời gian giá đỡ quang học, tốc độ xuyên hệ thống và hoạt động tẩy quang. Số lượng huỳnh quang tiềm năng và trình diễn hình ảnh GSD còn hạn chế, nhưng về mặt lý thuyết, có nhiều đầu dò huỳnh quang có thể được chụp ảnh thành công bằng kỹ thuật này.
Tương tự như STED, tia laser diệt phát quang trong kính hiển vi GSD được tạo hình với một đoạn pha xoắn ốc trên mặt sóng phân cực tròn để tạo ra hình doughnut với nút 0 ở giữa. Quét raster mẫu vật bằng các tia laser chồng lên nhau (kích thích và cạn kiệt) tạo ra hình ảnh có độ phân giải nhiễu xạ phụ. Lưu ý rằng có khả năng các fluorophores sẽ được xếp vào các trạng thái tối khác (trừ bộ ba siêu bền) bằng kính hiển vi GSD, nhưng kỹ thuật này vẫn sẽ tạo ra những hình ảnh có độ phân giải cao tuyệt vời với điều kiện là các fluorophores cuối cùng có thể trở lại trạng thái cơ bản. Khả năng khai thác độ bão hòa của trạng thái bộ ba với GSD bằng cách sử dụng công suất laser diệt phát quang thấp hơn nhiều bắt nguồn từ thời gian tồn tại một phần nghìn giây của trạng thái tối. Hơn nữa, mức ánh sáng yếu được sử dụng bởi kính hiển vi GSD tạo điều kiện thuận lợi cho việc sử dụng máy ảnh kỹ thuật số khi việc chụp ảnh được tiến hành với một dãy cường độ 0 song song. Giá đỡ quang học ở trạng thái bộ ba đã được chứng minh trong các đầu dò tổng hợp phổ biến, chẳng hạn như thuốc nhuộm ATTO, rhodamine, carbocyanines, Alexa Fluors, BODIPY và fluorescein. Trong số các phương tiện hình ảnh được cho là hữu ích cho GSD là rượu polyvinyl, dung môi nước và một số công thức phương tiện gắn kết có sẵn trên thị trường.
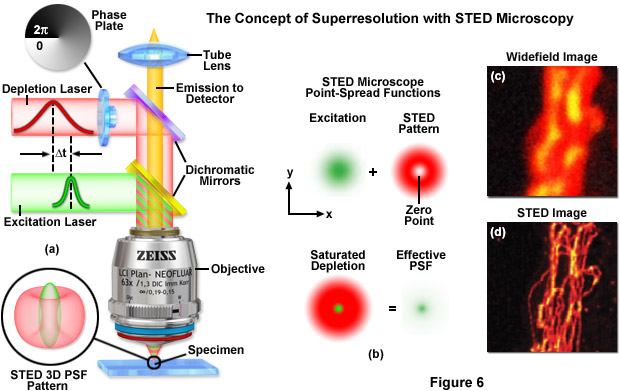
Minh họa trong Hình 7 là các hàm trải rộng điểm hiệu quả (Hình 7(a)), mật độ dân số của các trạng thái kích thích điện tử (Hình 7(b)) và các hình ảnh điển hình (Hình 7(c) đến 7(f)) cho kính hiển vi trường rộng và kính hiển vi GSD. Khi công suất laser diệt phát quang tăng ở chế độ GSD từ 1 lên 100 miliwatt (Hình 7(a)), chức năng trải rộng điểm hiệu dụng sẽ giảm xuống toàn bộ chiều rộng ở mức tối đa một nửa lần lượt là 90 nanomet, 33 nanomet và 12 nanomet. Xác suất quần thể của trạng thái cơ bản ( S 0 , đường cong màu đỏ) so với trạng thái đơn lẻ bị kích thích đầu tiên ( S 1 , đường cong màu xanh lá cây) và trạng thái bộ ba bị cấm ( T 1 , đường cong màu xanh lam) là một hàm của cường độ kích thích bằng laser đối với huỳnh quang truyền thống (fluorescein) được trình bày trong Hình 7(b). Lưu ý sự gia tăng đáng kể về dân số trạng thái bộ ba khi công suất laser tăng lên. Hình ảnh của các hạt huỳnh quang trong huỳnh quang trường rộng (Hình 7(c)) và với GSD (Hình 7(d)) cho thấy sự cải thiện đáng kể về độ phân giải, cũng như hình ảnh của các vi ống (Hình 7(e), trường rộng và Hình 7(f) , GSD) được dán nhãn bằng fluorophore tổng hợp.
Trong SSIM và SPEM, sự chiếu sáng có cấu trúc được tạo ra bởi hai chùm ánh sáng giao thoa mạnh từ một tia laser duy nhất tạo thành mô hình lưới sóng đứng chiếu qua các kích thước bên của mẫu vật. Chỉ bậc nhiễu xạ đầu tiên (+1 và -1) được sử dụng để tạo vân giao thoa và bậc 0 từ nguồn laser bị chặn bằng thiết bị chặn chùm tia. Hầu hết các đầu dò huỳnh quang phơi sáng trong mẫu thử đều bão hòa do tiếp xúc với ánh sáng mạnh, chỉ để lại các thể tích hình đường tối hẹp (không có nút) có chu kỳ khoảng 200 nanomet ở các cạnh của vân giao thoa. Khi năng lượng kích thích tăng lên, các bức tường bao quanh các nút trở nên lớn hơn nhiều, do đó làm giảm kích thước của hàm trải rộng điểm. Phương pháp này được triển khai trên kính hiển vi trường rộng, không quét bằng cách dịch pha mẫu để hiển thị thông tin siêu phân giải không thể giải quyết được, hiển thị dưới dạng tần số hài và các vân moiré cơ bản. Do độ phân giải chỉ được cải thiện theo hướng vuông góc với các nút 0 hình đường thẳng, mẫu phải được dịch chuyển theo nhiều hướng để bao phủ một số lượng lớn các góc trong mặt phẳng tiêu điểm.
Các kỹ thuật chiếu sáng có cấu trúc phi tuyến tính tương tự như kính hiển vi STED ở chỗ thời gian tiến hành các phép đo về mặt lý thuyết không phụ thuộc vào mật độ ghi nhãn và khả năng quang hóa của đầu dò huỳnh quang quyết định hiệu suất. Cơ chế tăng độ phân giải trong SSIM và SPEM được mô tả dưới dạng các thành phần Fourier và tần số không gian. Tuy nhiên, tương tự như các kỹ thuật kỹ thuật hàm trải rộng điểm khác của STED và GSD được mô tả ở trên, kính hiển vi chiếu sáng có cấu trúc phi tuyến tính tận dụng độ bão hòa ở trạng thái ổn định trong đó thông tin có độ phân giải cao chỉ thu được sau khi hệ thống đạt đến điều kiện bão hòa fluorophore. Ngoài ra, độ phân giải không gian tăng theo mức độ bão hòa để tạo ra hình ảnh có độ phân giải ngang trong khoảng 50 nanomet trong điều kiện tối ưu về tín hiệu trên tạp âm và quá trình tẩy quang thấp. Do thời gian cần thiết để xoay mô hình lưới được chiếu, mẫu vật phải bất động trong thời gian tương đối dài, nhưng các chất huỳnh quang phù hợp với SSIM và SPEM không yêu cầu các đặc tính chuyển đổi ảnh chuyên dụng.
Kính hiển vi siêu phân giải
Trong các triển khai truyền thống của kính hiển vi chiếu sáng có cấu trúc (ví dụ như ZEISS ApoTome), một lưới được tạo ra bằng cách làm bay hơi kim loại trên bề mặt tấm kính quang học được đưa vào mặt phẳng màng chắn trong đường chiếu sáng của kính hiển vi huỳnh quang và chiếu lên trên mẫu vật. Hình ảnh lưới chiếu được dịch qua mẫu vật bằng cách sử dụng một tấm kính phẳng song song nghiêng qua lại trong đường đi của ánh sáng. Ít nhất ba hình ảnh thô của mẫu vật được thu được với cấu trúc lưới được xếp chồng lên nhau ở các vị trí khác nhau. Những hình ảnh này sau đó được xử lý theo thời gian thực bằng phần mềm kính hiển vi để tạo ra một phần quang học. Nguyên tắc cơ bản là lưới chiếu sẽ hiển thị trong mặt phẳng tiêu điểm do các đặc điểm của mẫu vật bị kích thích bởi ánh sáng có cấu trúc. Ở những vùng không có ánh sáng tới mẫu vật (thực tế là các đường lưới tối), không có huỳnh quang được tạo ra. Phần mềm xác định độ tương phản lưới như một chức năng của vị trí và loại bỏ thông tin hình ảnh nằm ngoài tiêu cự trước khi đối chiếu ba hình ảnh thành một phần quang học cuối cùng có độ phân giải ngang và dọc trục tương tự như kính hiển vi đồng tiêu quét laser.
Độ phân giải ngang có thể được tăng lên vượt quá giới hạn Abbe cổ điển theo hệ số hai (khoảng 100 đến 120 nanomet) trong chiếu sáng có cấu trúc mà không loại bỏ bất kỳ ánh sáng phát xạ nào bằng cách sử dụng chiếu sáng có cấu trúc không gian được tạo ra bằng laser kết hợp với kính hiển vi huỳnh quang quét trường rộng trong cái được gọi là siêu phân giải (SR) SIM. Tương tự như kỹ thuật siêu phân giải phi tuyến tính của SSIM được mô tả ở trên, các mặt sóng ánh sáng có cấu trúc SR-SIM tuyến tính hiển thị thông tin có độ phân giải cao thường không thể tiếp cận được dưới dạng các vân moiré chứa tần số hài từ mẫu không có trong kính hiển vi huỳnh quang thông thường. Do đó, nếu hai mẫu đẹp được xếp chồng lên nhau theo kiểu nhân lên thì mẫu nhịp (rìa moiré) sẽ xuất hiện trong sản phẩm của chúng. Trong trường hợp này, một trong các mẫu là sự phân bố fluorophore trong không gian trong mẫu vật và mẫu còn lại là cường độ ánh sáng kích thích có cấu trúc. Như được mô tả chi tiết hơn bên dưới, bằng cách thu thập một tập hợp các hình ảnh có dạng lưới xoay 360 độ trong không gian bên, thông tin có độ phân giải cao có thể được phục hồi từ mẫu sau khi hoàn tất quá trình xử lý sau thu nhận.
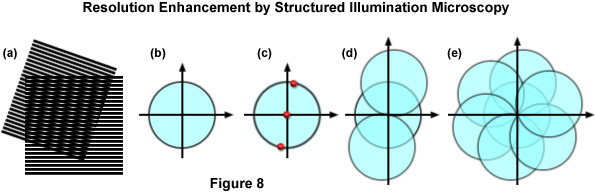
Trong ví dụ đơn giản nhất, cấu trúc chiếu sáng bao gồm mẫu sọc hình sin tạo ra biến đổi Fourier chỉ có ba điểm khác 0 (xem Hình 8(c)). Một điểm nằm ở điểm gốc và hai điểm còn lại được lệch so với điểm gốc theo hướng được xác định bởi hướng của mẫu lưới và theo khoảng cách tỷ lệ với khoảng cách dòng nghịch đảo của lưới. Khi mẫu vật được chiếu sáng bằng ánh sáng có cấu trúc do mô hình lưới tạo ra, các vân moiré sẽ xuất hiện biểu thị thông tin đã thay đổi vị trí trong không gian đối ứng. Ngoài thông tin mẫu vật bị giới hạn nhiễu xạ thông thường, vùng quan sát được hiện còn chứa thông tin tần số cao mới bắt nguồn từ hai vùng bù như minh họa trong Hình 8(d). Các vùng của các vòng tròn lệch trong Hình 8(d) nằm ngoài vòng tròn trung tâm biểu thị thông tin mới mà kính hiển vi thông thường không thể tiếp cận được. Nếu một chuỗi các hình ảnh như vậy có hướng và pha lưới khác nhau được tạo ra (Hình 8(e)), thông tin có thể được phục hồi từ một khu vực có kích thước gấp đôi khu vực có thể quan sát được thông thường để tăng độ phân giải ngang lên gấp hai lần.
Về mặt cấu hình thiết bị, tia laser có lẽ là lựa chọn phù hợp nhất để chiếu sáng SR-SIM với điều kiện ánh sáng bị xáo trộn về mặt không gian và phân cực tuyến tính. Hướng của các đường lưới phải song song với góc phương vị vectơ phân cực của ánh sáng kích thích và tất cả các bậc nhiễu xạ ngoại trừ bậc đầu tiên (+1 và -1) phải bị chặn. Khoảng 80 phần trăm ánh sáng thường bị nhiễu xạ thành các bậc đầu tiên để tạo ra mẫu có độ tương phản cao có chu kỳ khoảng 200 nanomet. Độ sâu biến điệu của mẫu sọc chiếu lên mẫu phải nằm trong khoảng từ 70 đến 90 phần trăm và cách tử được gắn trên một thiết bị dịch vòng kín, có thể xoay. Nên có sẵn một số kích thước cách tử để phù hợp với nhiều nguồn kích thích dòng laser. Một số thiết bị thương mại có khả năng chọn ba hoặc năm góc quay lưới (120 độ hoặc 72 độ) để tối ưu hóa tốc độ hoặc độ phân giải hình ảnh tương ứng. Sau khi thu thập, nhiều hình ảnh phụ cho mỗi hướng lưới và chuyển vị được xử lý thông qua một số bước phần mềm để tạo ra hình ảnh cuối cùng. Ở chế độ tốc độ được tối ưu hóa, thiết bị SR-SIM thương mại phải có khả năng chụp ảnh tế bào sống của các cấu trúc thiếu chuyển động đáng kể, chẳng hạn như Actin, nhiễm sắc thể phân bào, ty thể và bộ máy Golgi.
Kính hiển vi định vị đơn phân tử
Các kỹ thuật siêu phân giải 4Pi, InM, STED, GSD, SSIM và chiếu sáng có cấu trúc được thiết kế để ghi lại hình ảnh của một tập hợp các chất huỳnh quang phân bố khắp mẫu vật. Mặc dù các phương pháp này có độ phân giải khác nhau, nhưng tất cả chúng đều kích thích nhiều fluorophores trong giới hạn của chức năng trải rộng điểm đã được sửa đổi do cấu hình thiết bị cụ thể cung cấp. Ngược lại, các kỹ thuật đơn phân tử của kính hiển vi định vị quang hóa (PALM), kính hiển vi tái tạo quang học ngẫu nhiên (STORM) và kính hiển vi định vị quang hóa huỳnh quang ( FPALM ) khác nhau cơ bản ở chỗ chúng chụp ảnh các tập hợp con thưa thớt chứa các phân tử riêng lẻ cách nhau khoảng cách vượt quá giới hạn độ phân giải Abbe. Nguyên tắc cơ bản của các kỹ thuật này là vị trí của một phân tử có thể được định vị với độ chính xác vài nanomet (hoặc tốt hơn) nếu có thể thu thập đủ photon và thiếu các phân tử bổ sung (phát ra tương tự) trong phạm vi xấp xỉ 200 nanomet. Trong số các tính năng đáng mong đợi nhất của PALM, STORM và phương pháp liên quan là các kỹ thuật này không yêu cầu sửa đổi các đặc tính quang học của kính hiển vi đảo ngược tiêu chuẩn và có thể được thực hiện bằng bất kỳ thiết bị thương mại nào có khả năng thực hiện chụp ảnh đơn phân tử.
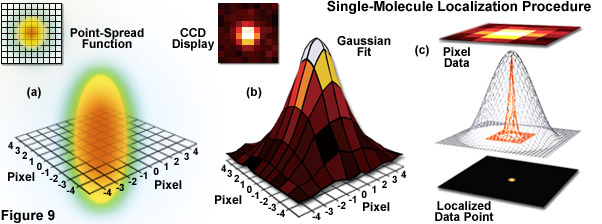
Đối với các mẫu được dán nhãn dày đặc (như thường thấy đối với các cấu trúc sinh học được dán nhãn bằng protein huỳnh quang hoặc miễn dịch huỳnh quang kết hợp với thuốc nhuộm tổng hợp), độ chính xác định vị không trực tiếp chuyển thành hình ảnh siêu phân giải do thực tế là các hình ảnh chồng chéo phát ra fluorophores đồng thời ngăn cản việc định vị chính xác của chúng. Để phá vỡ “bản chất tập hợp” của hầu như tất cả các mẫu sinh học có nhãn huỳnh quang, PALM và STORM được thiết kế để xác định vị trí chính xác của các nguồn phát phân tử đơn lẻ bằng cách “bật” huỳnh quang theo tuần tự trong các tập hợp con giới hạn của các phân tử trước khi cố gắng xác định tọa độ. Không giống như STED và GSD, trong đó chức năng trải rộng điểm được xác định chính xác được tạo ra bởi các tia laser chồng lên nhau được quét qua mẫu vật để kích thích tất cả các phân tử trong thể tích tiêu cự, các kỹ thuật phân tử đơn dựa vào chuyển đổi quang học ngẫu nhiên trong đó hầu hết các phân tử vẫn tối. Sau khi kích thích bằng laser kích hoạt ở công suất thấp, một tỷ lệ nhỏ các phân tử được bật ngẫu nhiên, chụp ảnh, định vị và sau đó được tẩy quang để loại bỏ chúng khỏi quần thể (xem Hình 9). Lặp lại quá trình này trong nhiều chu kỳ là ý tưởng sáng tạo đằng sau kính hiển vi định vị phân tử đơn cho phép tái tạo hình ảnh siêu phân giải.
Khái niệm xác định và định vị các phân tử riêng lẻ lần đầu tiên được mô tả bởi Werner Heisenberg vào những năm 1930 và được chính thức củng cố bằng nền tảng toán học vững chắc trong những năm 1980 và 1990 bởi một số nhóm. Về cơ bản, trong trường mẫu bên chứa các bộ phát phân tử đơn lẻ, phần trung tâm của từng điểm giới hạn nhiễu xạ được ghi trên mặt phẳng hình ảnh của máy ảnh kỹ thuật số tương ứng với vị trí của một phân tử và có thể được định vị với độ chính xác nanomet cao bằng cách thu thập đủ số lượng photon . Các phương pháp xác định tâm định vị dựa trên đường cong thống kê khớp với phân bố photon đo được theo hàm Gaussian. Mục tiêu cuối cùng là xác định giá trị trung tâm hoặc giá trị trung bình của phân bố photon ( μ = x 0 , y 0 ), và độ không đảm bảo của nó, sai số chuẩn của giá trị trung bình, σ , theo phương trình:
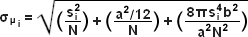 (4)
(4)
Trong đó N là số lượng photon được thu thập, a là kích thước pixel của máy dò hình ảnh, b là độ lệch chuẩn của nền (bao gồm phát xạ huỳnh quang nền kết hợp với nhiễu của máy dò) và s i là độ lệch chuẩn hoặc chiều rộng của phân phối (theo hướng i ). Chỉ số i đề cập đến hướng x hoặc y . Thuật ngữ đầu tiên dưới căn bậc hai ở phía bên phải của phương trình (4) đề cập đến nhiễu photon, trong khi thuật ngữ thứ hai bao gồm ảnh hưởng của kích thước pixel hữu hạn của máy dò. Thuật ngữ cuối cùng có tính đến ảnh hưởng của nhiễu nền. Bằng cách áp dụng các kỹ thuật đơn giản này, có thể đạt được độ chính xác định vị khoảng 10 nanomet với sự phân bố photon khoảng 1000 photon khi nhiễu nền không đáng kể. Việc mở rộng hiểu biết này đã dẫn đến một loạt các thí nghiệm khéo léo nghiên cứu các cấu trúc biệt lập cách nhau ít hơn giới hạn nhiễu xạ, chẳng hạn như các động cơ phân tử được dán nhãn. Một sự phát triển công nghệ quan trọng trong việc hỗ trợ siêu phân giải dựa trên đầu dò là sự sẵn có rộng rãi và dễ sử dụng của các hệ thống máy ảnh thiết bị ghép điện tích nhân điện tử (EMCCD), có độ nhạy đơn photon.
Như được mô tả trong Phương trình (3), điều mang lại kết quả có độ chính xác cao cho việc định vị phân tử trong hình ảnh siêu phân giải đơn phân tử là giảm thiểu nhiễu nền và tối đa hóa lượng photon phát ra từ đầu dò huỳnh quang, một nhiệm vụ được mô tả dễ dàng hơn là hoàn thành. Trong trường hợp tốt nhất, nếu có thể thu thập 10.000 photon trong điều kiện không có nền trước khi tẩy fluorophore hoặc tắt, thì tâm định vị có thể được xác định với độ chính xác khoảng 1 đến 2 nanomet. Ngược lại, nếu chỉ thu thập được 400 photon, độ chính xác định vị sẽ giảm xuống khoảng 20 nanomet hoặc tệ hơn. Bối cảnh trong các mẫu siêu phân giải phát sinh từ sự tự phát huỳnh quang tự nhiên hoặc do thuốc thử gây ra (từ chất cố định hoặc hóa chất chuyển hóa), cũng như từ huỳnh quang còn sót lại của các đầu dò xung quanh đã chuyển sang trạng thái tối. Do đó, đối với các kỹ thuật chụp ảnh siêu phân giải đơn phân tử dựa trên đầu dò như PALM, các phân tử huỳnh quang phải hiển thị tỷ lệ tương phản cao (hoặc dải động), được định nghĩa là tỷ lệ huỳnh quang trước và sau quá trình quang hóa. Sự thay đổi tỷ lệ tương phản trong protein huỳnh quang và fluorophores tổng hợp là do sự khác biệt trong quá trình quang hóa tự phát của chúng khi không có sự kích hoạt có kiểm soát.
Hình ảnh đơn phân tử lần đầu tiên được chứng minh vào năm 1989, đầu tiên là ở nhiệt độ đông lạnh và sau đó là ở nhiệt độ phòng bằng kính hiển vi quang học quét trường gần. Kể từ thời điểm đó, phương pháp này đã phát triển thành một kỹ thuật kính hiển vi trường rộng tiêu chuẩn. Kiến thức trước đây rằng hình ảnh giới hạn nhiễu xạ của một phân tử bắt nguồn từ một nguồn duy nhất cho phép ước tính vị trí (trung tâm) của phân tử đó với độ chính xác vượt xa giới hạn nhiễu xạ. Một ứng dụng ban đầu của khái niệm này đã được trình bày với một kỹ thuật được gọi là chụp ảnh huỳnh quang với độ chính xác một nanomet ( FIONA ) để định vị và theo dõi các nguồn phát phân tử đơn bằng cách tìm ra tâm của hàm trải điểm giới hạn nhiễu xạ của chúng. FIONA đã được sử dụng để chứng minh thành công kích thước bước tính bằng nanomet với độ chính xác cực cao của động cơ myosin khi chúng dịch chuyển chiều dài của sợi Actin. Một minh chứng khác gọi là kính hiển vi huỳnh quang đa phân tử đơn định vị nanomet (NALMS) sử dụng phương pháp tẩy quang để loại bỏ có chọn lọc các phân tử đơn lẻ nhằm đo khoảng cách giữa các đầu dò huỳnh quang giống hệt nhau chồng lên nhau trong một điểm giới hạn nhiễu xạ.
Một số kỹ thuật đơn phân tử khác với các từ viết tắt thú vị cũng đã được báo cáo. Một kỹ thuật được gọi là hình ảnh có độ phân giải cao phân tử đơn với quá trình tẩy trắng (SHRImP) có liên quan đến FIONA và sử dụng quá trình tẩy quang của hai hoặc nhiều fluorophores giống hệt nhau có khoảng cách gần nhau để xác định tuần tự vị trí của chúng bằng cách sử dụng các kỹ thuật định vị phân tử đơn bắt đầu từ fluorophore cuối cùng đã được tẩy trắng. Tương tự như vậy, một phiên bản hai màu của FIONA sử dụng các điểm đánh dấu ủy thác để đo lường việc đăng ký giữa hai kênh phát hiện đã được giới thiệu dưới tên gọi colocalization độ phân giải cao phân tử đơn (SHREC). Việc áp dụng liên kết đặc hiệu hoặc không đặc hiệu liên tục của các đầu dò huỳnh quang khuếch tán với mục tiêu sinh học cố định, sau đó là quá trình tẩy quang để tạo ảnh có độ phân giải cao được gọi là tích lũy điểm để tạo ảnh trong địa hình kích thước nano (PAINT). Các nghiên cứu khác đã tập trung vào việc sử dụng các chấm lượng tử riêng lẻ cho các nghiên cứu định vị dựa trên sự xâm nhập ngẫu nhiên của chúng vào trạng thái tối, trong khi việc tách và định vị các fluorophores riêng lẻ khác nhau trong cấu hình quang phổ của chúng là mục tiêu của một số thí nghiệm được thiết kế để phân lập các phân tử đơn lẻ ở độ phân giải cao.
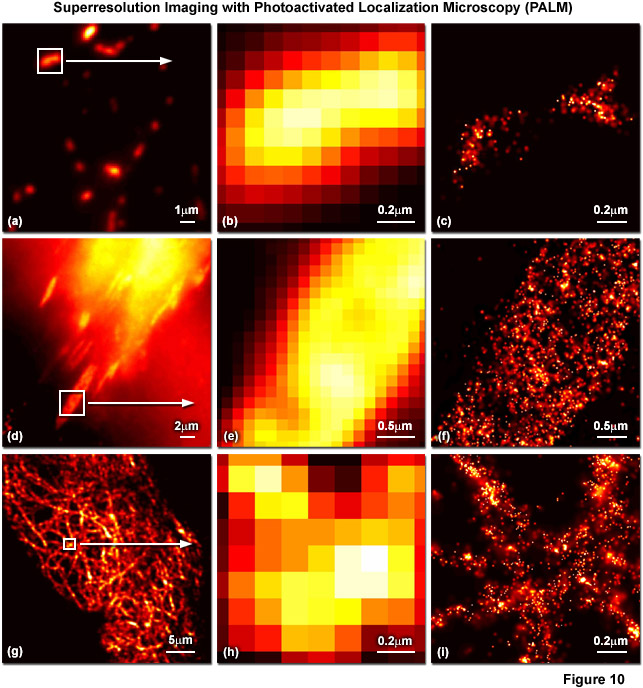
Hạn chế chính của các kỹ thuật đơn phân tử được mô tả ở trên là chúng chỉ hữu ích khi các đầu dò huỳnh quang cách ly tốt với nhau, thường ở mật độ khoảng từ 10 đến 100 phân tử trên micromet vuông. Khoảng cách giữa các phân tử lớn như vậy đảm bảo rằng sự phân bố trọng tâm của từng đầu dò có thể được điều chỉnh chính xác. Tuy nhiên, không có phương pháp nào trong số này xác định một cơ chế phân tử riêng biệt cho phép đọc tuần tự các cá thể từ một nhóm lớn các chất phát quang, và phải đến khi chuyển đổi quang học (hoặc chuyển đổi quang học) giữa hai trạng thái phát xạ riêng biệt được áp dụng trong hình ảnh PALM và STORM thì siêu phân giải ngẫu nhiên mới được áp dụng trên kính hiển vi đã được thực hiện. Những kỹ thuật này chứng minh rằng hình ảnh đơn phân tử có thể được sử dụng để nghiên cứu nồng độ dày đặc của đầu dò huỳnh quang (trong khoảng 100.000 trên micromet vuông) trong khi vẫn đạt được độ phân giải đo bằng hàng chục nanomet. Do đó, với các protein huỳnh quang đánh dấu quang học hoặc thuốc nhuộm carbocyanine có thể chuyển đổi quang học, tia laser kích hoạt được sử dụng ở công suất thấp được sử dụng để kích hoạt chuyển đổi phát xạ sao cho bất kỳ phân tử cụ thể nào cũng có xác suất bị quang hóa nhỏ, nhưng phần lớn quần thể vẫn ở trạng thái ban đầu ( trạng thái phát xạ tối hoặc tự nhiên).
Trong PALM, STORM và các kỹ thuật định vị phân tử đơn có liên quan, trạng thái kích hoạt của các phân tử có thể chuyển đổi quang học phải dẫn đến sự phát xạ liên tiếp đủ lượng photon để cho phép định vị chính xác trước khi đầu dò quay trở lại trạng thái tối hoặc bị vô hiệu hóa do quá trình tẩy quang. Việc đảm bảo rằng các phân tử được kích hoạt thưa thớt cách xa nhau hơn giới hạn Abbe là rất quan trọng để cho phép ghi song song nhiều cá thể, mỗi cá thể có tọa độ riêng biệt tạo ra các điểm nhiễu xạ duy nhất trên máy dò mảng khu vực của máy ảnh kỹ thuật số. Như đã mô tả ở trên, các trọng tâm thu được từ hình ảnh của các phân tử riêng lẻ này mang lại tọa độ phân tử có độ chính xác dựa trên số lượng photon phát ra. Sau khi xác định được vị trí phân tử, tọa độ sẽ được ghi lại dưới dạng dấu tích trong chiều bên và quá trình được lặp lại. Do thực tế là số lượng photon phát ra khác nhau đối với mỗi phân tử, nên có thể thiết lập ngưỡng độ sáng tối thiểu (ví dụ: những phân tử đó phát ra hơn 25 photon) để đạt được độ phân giải mong muốn.
Các biến thể của PALM và STORM bao gồm một kỹ thuật được gọi là PALM với hoạt động thu nhận hoạt động độc lập (PALMIRA), trong đó máy ảnh được vận hành ở tốc độ cao mà không đồng bộ hóa với laser kích hoạt hoặc chu kỳ chuyển đổi tắt bật của đầu dò huỳnh quang. PALMIRA yêu cầu sử dụng fluorophores có thể chuyển đổi thuận nghịch nhưng tăng tốc đáng kể tốc độ thu nhận hình ảnh (khoảng 100 lần). Một phương pháp khác được gọi là làm suy giảm trạng thái cơ bản bằng phản hồi phân tử đơn (GSDIM) tạo ra trạng thái tối của fluorophore tổng hợp bằng cách đưa nó vào trạng thái bộ ba siêu bền (tương tự như kính hiển vi GSD), sau đó theo dõi các nguồn phát khi chúng quay trở lại mặt đất một cách ngẫu nhiên tình trạng. Một số kỹ thuật tương tự đã xuất hiện tận dụng lợi thế của hiện tượng này và các hiện tượng liên quan, bao gồm kính hiển vi blink và nhiều công cụ phái sinh khác được biểu thị bằng một loạt các từ viết tắt mới dường như vô tận. Tiềm năng đáng kể nhất mà các phương pháp mới này mang lại là chúng có thể tạo ra hình ảnh siêu phân giải bằng cách sử dụng các đầu dò huỳnh quang tổng hợp tiêu chuẩn, chẳng hạn như fluorescein, Alexa Fluor 488, ATTO 650, Cy5 và nhiều loại thuốc nhuộm tương tự khi có mặt chất tẩy oxy và thiol béo.
Mặc dù các kỹ thuật siêu phân giải đơn phân tử đã được chứng minh là cực kỳ chính xác về khả năng định vị các đầu dò huỳnh quang ở các chiều bên, việc đạt được độ phân giải tương tự ở chiều trục đã được chứng minh là khó khăn hơn. Phiên bản ba chiều của STORM (3D-STORM) điều chỉnh một thấu kính hình trụ để làm lệch chức năng trải rộng điểm của huỳnh quang đơn phân tử theo hướng ngang tùy thuộc vào vị trí của nó dọc theo trục z . Biplane (BP) FPALM sử dụng cấu hình hình ảnh mặt phẳng kép để chiếu hình ảnh của cùng một phân tử vào hai mặt phẳng tiêu cự khác nhau. Một kỹ thuật có tên là chức năng trải rộng điểm xoắn kép (DH-PSF) thiết kế chức năng trải rộng điểm của kính hiển vi thành hai thùy, được xoay đối với hình ảnh tùy thuộc vào vị trí trục của chúng. Cuối cùng, PALM giao thoa kế (iPALM) thu thập ánh sáng từ các bộ phát đơn lẻ bằng cách sử dụng các vật kính kép đặt cạnh nhau, kết hợp lại sự phát xạ và sử dụng sự giao thoa của các photon dựa trên vị trí của chúng trong mặt phẳng tiêu cự để xác định vị trí trục. Mặc dù hầu hết các kỹ thuật này được thiết kế để tăng độ phân giải theo trục không đạt được hiệu suất của chúng ở các chiều bên, nhưng iPALM thực sự có khả năng mang lại độ phân giải theo trục tương đương hoặc tốt hơn PALM ở chiều bên.
Các kỹ thuật định vị phân tử mật độ cao vẫn còn ở giai đoạn sơ khai vì các ví dụ mới đang được phát triển và báo cáo thường xuyên, tuy nhiên, nhiều khái niệm được thảo luận ở trên hứa hẹn sẽ trở thành công cụ hàng ngày trong sinh học tế bào và các ngành liên quan. Tại thời điểm này, nhiều ví dụ được công bố về phương pháp siêu phân giải đơn phân tử và tập hợp chủ yếu liên quan đến bằng chứng về nguyên lý hoặc sự ra đời của các đầu dò huỳnh quang mới. Các phân tử mục tiêu được ưa chuộng trong các nghiên cứu này là Actin và vi ống, là các thử nghiệm độ phân giải tuyệt vời vì chúng có các cấu trúc tế bào đặc trưng, riêng biệt và thường có nhiều sợi có đường kính 25 nanomet hoặc nhỏ hơn và nằm ở các khoảng cách khác nhau. Các ví dụ về hình ảnh hai màu và hình ảnh tế bào sống được báo cáo ít thường xuyên hơn, nhưng tất cả các phương pháp được mô tả ở đây có thể sẽ trở nên tinh tế hơn và do đó hữu ích cho việc nghiên cứu một loạt các hiện tượng sinh học.
Kết luận
Một loạt các kỹ thuật siêu phân giải hiện có ngày nay đang chuyển hình ảnh quang học của các mẫu vật sinh học vào lĩnh vực truyền thống được giữ bằng kính hiển vi điện tử, nhưng cần thận trọng khi giải thích các cấu trúc và phân bố phân tử được quan sát. Điểm chính là phải đảm bảo rằng các kỹ thuật hoạt động như được giới thiệu. Trong hầu hết các trường hợp, các kỹ thuật, phần mềm và thiết bị được mô tả trong các đoạn trên chỉ được phát triển bởi một số nhà khoa học sáng tạo, do đó, vẫn còn khá nhiều chỗ để mở rộng lĩnh vực phôi thai này. Đối với nhiều thiết bị có độ phân giải siêu cao, các bộ phận thành phần đều có sẵn trên thị trường hoặc có thể dễ dàng chế tạo, về cơ bản vấn đề nằm ở vấn đề chi phí. Các kỹ thuật tổng hợp của STED, chiếu sáng có cấu trúc và 4Pi đều có sẵn trên thị trường và các công cụ bổ sung sẽ xuất hiện trong vài năm tới. Những sự kiện này sẽ mang lại lợi ích cho các nhà sinh học tế bào, những người không thể chế tạo các công cụ và/hoặc phần mềm lập trình riêng nhưng muốn tiến hành các thí nghiệm ở độ phân giải cao.
Nguồn: https://zeiss-campus.magnet.fsu.edu/articles/superresolution/introduction.html



 EN
EN