Giới thiệu về hóa mô miễn dịch
Giới thiệu về nhuộm IHC
IHC được sử dụng trong mô học để phát hiện sự hiện diện của các dấu hiệu protein cụ thể có thể hỗ trợ phân loại và chẩn đoán khối u chính xác. IHC đã phát triển để bổ sung cho các kỹ thuật nhuộm Hematoxylin & Eosin (H&E) và Nhuộm đặc biệt thường cho thấy hình thái mô (cấu trúc). Trong khi H&E và Nhuộm đặc biệt không đặc hiệu, IHC hướng đến một hoặc nhiều dấu hiệu protein cụ thể. IHC được sử dụng như một công cụ chẩn đoán để hỗ trợ chẩn đoán khối u rắn và mẫu tế bào học và đã được sử dụng như một công cụ chẩn đoán chính thống trong gần nửa thế kỷ.
Kháng nguyên mục tiêu
Kháng nguyên là protein nằm bên trong hoặc trên bề mặt tế bào. Các nhà nghiên cứu bệnh học tìm kiếm sự hiện diện hoặc vắng mặt của các kháng nguyên cụ thể để hỗ trợ chẩn đoán.
Có hàng trăm kháng nguyên được phát hiện có ích cho chẩn đoán. Thông thường, một nhà nghiên cứu bệnh học sẽ sử dụng một “bảng” gồm nhiều kháng nguyên để giúp phân loại đầy đủ một khối u cụ thể.
Kháng thể chính
Giai đoạn đầu tiên của IHC là sử dụng kháng thể chính có khả năng liên kết đặc hiệu với kháng nguyên mục tiêu.
Có hai loại kháng thể chính, đa dòng và đơn dòng. Kháng thể đa dòng có ái lực với và liên kết với nhiều epitope (hoặc các phần) hoặc kháng nguyên đích, và do đó dễ phản ứng chéo với các kháng nguyên không phải đích hơn.
Kháng thể đơn dòng chỉ có ái lực với một epitope và có xu hướng tạo ra nhuộm màu đặc hiệu hơn nhưng ít nhạy hoặc ít mạnh hơn.
Kháng thể thứ cấp
Tiếp theo, kháng thể thứ cấp liên kết với kháng thể chính. Đây được gọi là IHC gián tiếp. Hiện nay, nó thường được sử dụng vì nhiều kháng thể thứ cấp có thể liên kết với một kháng thể chính duy nhất để khuếch đại cường độ nhuộm.
Hệ thống phát hiện
Hệ thống phát hiện được xây dựng dựa trên thứ cấp. Phát hiện sắc tố hiện đại sử dụng các enzyme như Horseradish Peroxidase (HRP) được liên hợp (kết hợp) với kháng thể. Nhiều enzyme gắn vào kháng thể được gọi là polyme và chúng lại tạo ra sự nhuộm màu mạnh hơn vì có nhiều phân tử hơn để sắc tố bám vào.
Chất tạo màu
Cuối cùng, một chất nền tạo thành một chất kết tủa màu không hòa tan có thể được quan sát dưới kính hiển vi. Có hai chất tạo màu thường được sử dụng: DAB (nâu) hoặc AP (đỏ).
DAB được sử dụng cho hầu hết các ứng dụng vì nó cung cấp nhuộm màu mạnh và lâu dài. AP Red (hoặc một chất tạo màu đỏ khác) chủ yếu được sử dụng cho các phần da mà DAB màu nâu có thể bị che khuất bởi sắc tố melanin màu nâu.
Cả DAB và AP Red đôi khi được sử dụng trong cùng một phần mô để cho phép nhà nghiên cứu bệnh học hình dung hai kháng nguyên trong một slide. Đây là một quá trình được gọi là nhuộm kép.
Nhuộm IHC hoàn chỉnh
Đây là vết nhuộm IHC điển hình, trong đó chất kết tủa màu nâu chỉ ra sự hiện diện của kháng nguyên mục tiêu – trong trường hợp này là Cytokeratin 5 trên sinh thiết tuyến tiền liệt. Lượng nhuộm, kiểu nhuộm và vị trí nhuộm (nhân tế bào chất hoặc màng) đều cung cấp thông tin cho nhà bệnh học chẩn đoán.
Nền xanh là thuốc nhuộm đối kháng hematoxylin thường được áp dụng sau chất tạo màu. Thuốc nhuộm đối kháng cung cấp độ tương phản với chất tạo màu và cũng giúp nhà nghiên cứu bệnh học hình dung cấu trúc mô bên dưới.
15 bước để nhuộm IHC tốt hơn
Từ bệnh nhân đến bác sĩ giải phẫu bệnh, việc chuẩn bị mẫu mô để xét nghiệm mô học đòi hỏi sự cẩn thận, kỹ năng và quy trình hợp lý. Hướng dẫn này cung cấp lời khuyên thực tế về các kỹ thuật thực hành tốt nhất và các cách đơn giản để tránh các lỗi thường gặp.
Bước 1 – Sử dụng các phần cắt chất lượng cao
Đặc biệt cẩn thận khi sử dụng các lát cắt mỏng, phẳng đã được làm khô hoàn toàn trên phiến kính. Tốt nhất là sử dụng các phiến kính được tích điện hoặc các phiến kính được phủ APES cho IHC
Các lát cắt không đều, bám dính kém sẽ nhuộm màu không đều với màu nền khác nhau.
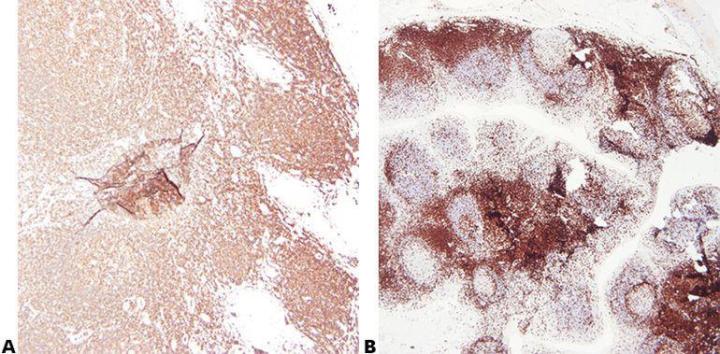
Bước 2 – Đảm bảo cố định tối ưu
Việc cố định chất lượng tốt bằng cách sử dụng các điều kiện cố định đã biết và nhất quán (loại chất cố định, độ pH, nhiệt độ, thời gian) sẽ mang lại kết quả tốt nhất. Các mẫu vật nên được kiểm tra trước khi xử lý để xác định xem có cần cố định thêm hay không.
Điều kiện cố định không nhất quán, tạo ra các mô cố định không đủ hoặc cố định quá mức, dẫn đến kết quả khác nhau và gây khó khăn cho việc khắc phục sự cố.

Bước 3 – Ngăn mẫu mô bị bong ra
Tránh sử dụng chất kết dính gốc protein trong bể căng mô (keo, tinh bột hoặc gelatin), đặc biệt là trên các phiến kính tích điện.
Chất kết dính gốc protein có thể chặn bề mặt của phiến kính tích điện. Điều này gây ra sự kết dính không đồng đều và dẫn đến nhuộm màu không đều do thuốc thử IHC tập trung bên dưới các phần mô bị nhấc lên.

Bước 4 – Tránh sự chênh lệch nồng độ
Có thể tránh được sự chênh lệch nồng độ bằng cách sử dụng thuốc thử một cách cẩn thận.
“Đôi khi chúng tôi thấy vết nhuộm đậm ở một đầu của phiến kính chuyển sang vết nhuộm nhạt ở đầu kia.”
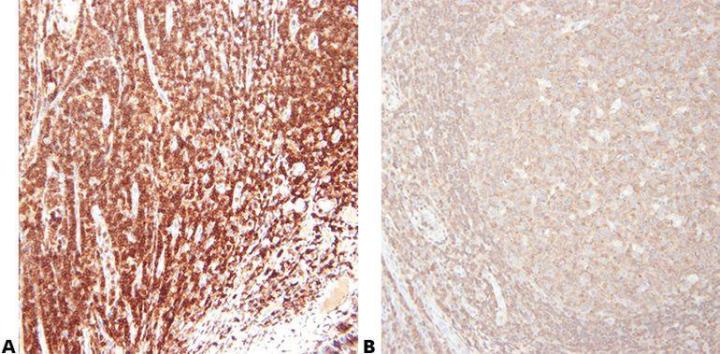
Bước 5 – Chọn kháng thể cẩn thận
Hãy lựa chọn kháng thể chính một cách cẩn thận liên quan đến độ nhạy và độ đặc hiệu của nó. Lưu ý rằng các kháng thể do các nhà cung cấp khác nhau bán thường có nguồn gốc từ cùng một nguồn và được gắn nhãn để bán. Điều quan trọng là phải sử dụng tên bản sao khi đánh giá kháng thể.
“Chúng tôi mua kháng thể chỉ dựa trên giá cả.”

Bước 6 – Đọc bảng thông số kỹ thuật
Biết được kháng thể chính. Luôn kiểm tra bảng thông số kỹ thuật để xác định tính phù hợp của phương pháp đối với một kháng thể cụ thể. Bảng thông số kỹ thuật nên được cập nhật khi mua một lô kháng thể mới.
“Chúng tôi không có quyền truy cập vào các bảng thông số kỹ thuật kháng thể trong phòng thí nghiệm của mình.”
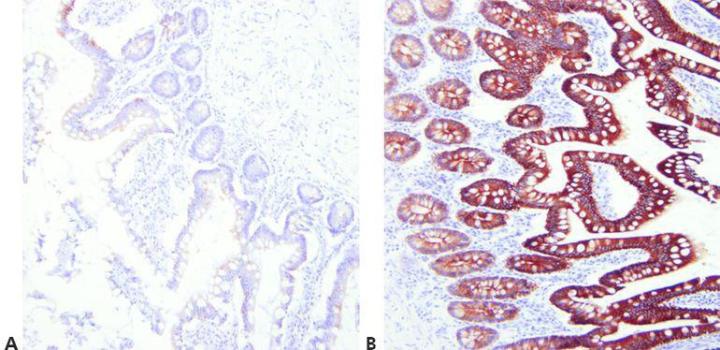
Bước 7 – Tối ưu hóa phương pháp truy xuất
Chọn điều kiện tách lớp thích hợp cho kháng thể chính được sử dụng, mô được nhuộm và phương pháp cố định được sử dụng (pH, thuốc thử, điều kiện phản ứng).
Kỹ thuật truy xuất tương tự được sử dụng cho tất cả các dữ liệu chính với giả định rằng có một phương pháp HIER phổ quát thành công.
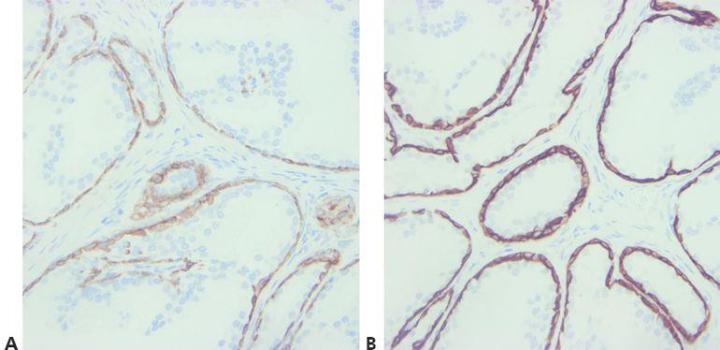
Bước 8 – Xem xét phản ứng chéo của kháng thể
Hãy lưu ý đến bất kỳ vấn đề tiềm ẩn nào liên quan đến phản ứng chéo của kháng thể (đọc thông số kỹ thuật).
Không có nỗ lực nào được đưa ra để giải thích hiện tượng nhuộm màu dương tính bất ngờ.
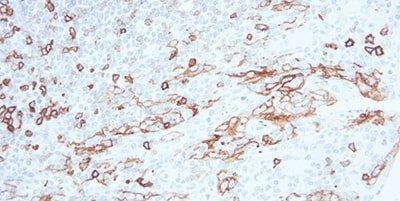
Bước 9 – Ngăn chặn hoạt động của enzyme peroxidase có trong mô
Đối với hệ thống phát hiện dựa trên peroxidase, luôn sử dụng bước chặn peroxidase.
Nhuộm không đặc hiệu thường thấy ở hồng cầu, bạch cầu hạt, bạch cầu đơn nhân và ở cơ. Điều này là do peroxidase có trong mô không được chặn hoàn toàn.
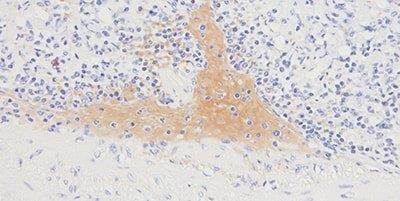
Bước 10 – Giảm thiểu nhuộm nền
Luôn sử dụng khối protein thích hợp.
Đôi khi thấy hiện tượng nhuộm nền tổng quát do sự ngăn chặn protein không hiệu quả.

Bước 11 – Sử dụng hệ thống phát hiện thích hợp
Chọn hệ thống phát hiện phù hợp có khả năng nhuộm màu chính xác, cụ thể với độ nhạy đủ.
“Chúng tôi đã sử dụng cùng một hệ thống phát hiện trong một thời gian dài và không thấy lý do gì để thay đổi. Đôi khi nhuộm màu yếu và không sắc nét như mong đợi.”
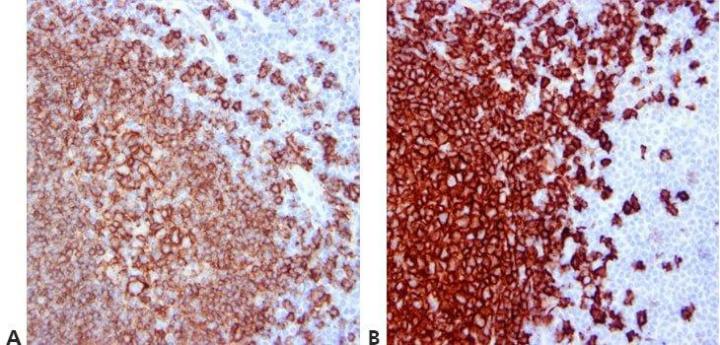
Bước 12 – Chuẩn hóa các bước rửa
Sử dụng các bước rửa chuẩn hóa trong suốt quá trình (thời gian, thể tích và hình thức khuấy). Điều này sẽ đảm bảo tính nhất quán của kết quả.
Kết quả rất khác nhau trong các lần chạy với cùng một kháng thể và giữa các lần chạy vào những ngày khác nhau. Điều này có thể là do các kỹ thuật rửa khác nhau được sử dụng bởi các kỹ thuật viên khác nhau.
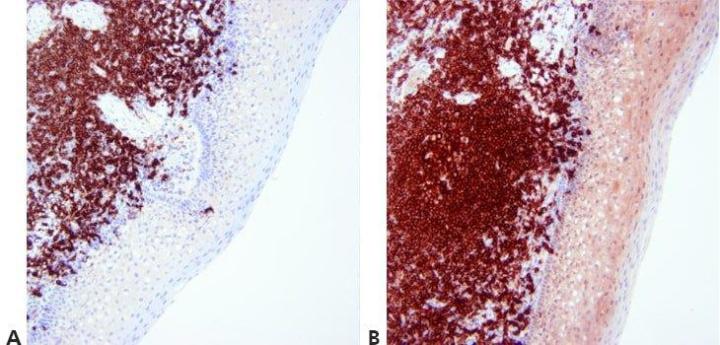
Bước 13 – Tối ưu hóa nhuộm màu đối lập
Mức độ nhuộm đối lập hạt nhân được điều chỉnh và chuẩn hóa cẩn thận để không làm mờ nhuộm dương tính. Nhuộm đối lập phải cung cấp độ tương phản tốt nhất có thể giữa chất tạo màu và các thành phần mô nền. Một chất nhuộm đối lập thích hợp được chọn cho chất tạo màu được sử dụng.
Phản ứng nhuộm hạt nhân đôi khi rất mạnh. Điều này có thể che khuất nhuộm đặc hiệu yếu.
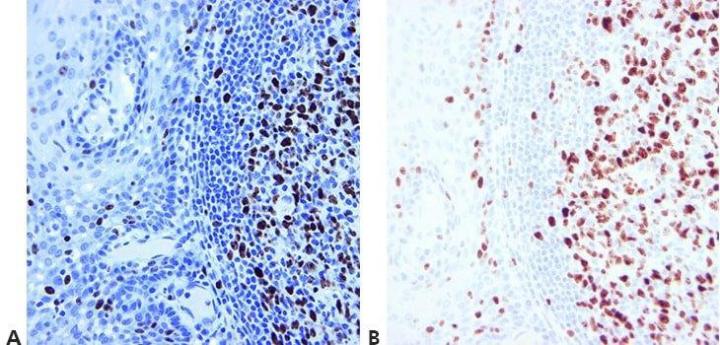
Bước 14 – Kiểm soát phù hợp
Luôn sử dụng các biện pháp kiểm soát dương tính và âm tính thích hợp được kiểm tra cẩn thận để xác nhận kết quả. Các biện pháp kiểm soát dương tính và âm tính nội bộ cũng quan trọng và cung cấp một phương tiện tối ưu để đảm bảo chất lượng trong IHC
“Chúng tôi chỉ thực hiện kiểm tra khi phương pháp có vẻ không hiệu quả”
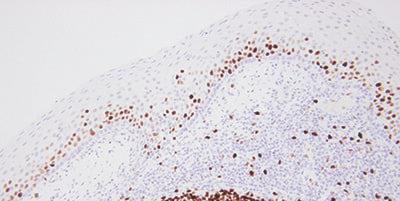
Bước 15 – Đánh giá kết quả cẩn thận
Biết những gì cần tìm và nơi cần tìm khi đánh giá các phần thử nghiệm và đối chứng sau khi nhuộm.
Nếu quan sát thấy vết nhuộm ở các phần thử nghiệm thì coi như vết nhuộm đó đạt yêu cầu.
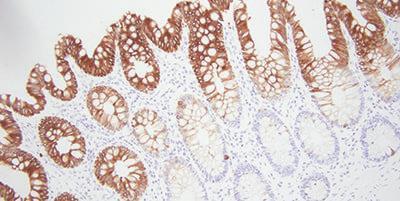
Bonus tip: Chọn kháng thể phù hợp
Một bước đơn giản nhưng đôi khi bị bỏ qua là chọn kháng thể có tác dụng với miễn dịch mô học. Điều này có thể giúp bạn tránh được nhiều vấn đề sau này.
Có một số điều cần lưu ý với kháng thể. Những gì có thể hoạt động tốt trong một phòng thí nghiệm có thể không tối ưu cho phòng thí nghiệm của bạn. Mỗi kháng thể cần được thử nghiệm bằng hệ thống nhuộm. Theo thời gian, kháng thể có thể mất cường độ nhuộm khi tiếp xúc với không khí và ánh sáng
Kháng thể cô đặc so với kháng thể RTU
Khi lựa chọn kháng thể, có hai lựa chọn chính cần cân nhắc: định dạng cô đặc hoặc định dạng pha loãng trước, Sẵn sàng sử dụng (RTU). Các chất cô đặc linh hoạt, có giá mua ban đầu thấp hơn và thường có thể sử dụng trong bất kỳ hệ thống nhuộm nào, cả tự động và thủ công, tùy thuộc vào khuyến nghị của nhà sản xuất. Độ pha loãng làm việc của các chất cô đặc có thể được tối ưu hóa để cân bằng chi phí, thời gian nhuộm và chất lượng. Với phạm vi pha loãng làm việc lớn, các chất cô đặc có thể được thay đổi bất kỳ lúc nào để phù hợp với các thay đổi trong thực hành phòng thí nghiệm hoặc cho nhiều giao thức cho một kháng thể cụ thể. Tuy nhiên, các chất cô đặc cần thời gian chuẩn bị và xác nhận. Vì không có cách xác định chắc chắn nào để xác định các đặc tính và độ ổn định của kháng thể pha loãng mà không có các nghiên cứu được kiểm soát và thực hiện tốt, nên chất lượng nhuộm có thể bị ảnh hưởng vì có thể không nhận thấy sự suy giảm. Ưu điểm của RTU bao gồm hiệu quả phòng thí nghiệm tăng lên, kiểm soát chất lượng tốt hơn và quản lý thuốc thử dễ dàng hơn. Chúng loại bỏ thời gian dành cho pha loãng làm việc, chuẩn bị và thời gian xác nhận xét nghiệm. Tính nhất quán được tăng cường với sự thay đổi giữa các lần chạy được giảm bớt, đặc biệt là khi kết hợp với máy nhuộm tự động và các hệ thống phát hiện liên quan. Với số lượng xét nghiệm được xác định và ngày hết hạn được nhà sản xuất xác minh, RTU đơn giản hóa việc quản lý kháng thể. Ngoài ra, RTU có thể đóng góp vào sự phát triển của phòng xét nghiệm bằng cách giúp dễ dàng áp dụng các xét nghiệm kháng thể mới vì lượng công việc xác thực được giảm đáng kể.
Bonus tip: Chuẩn hóa trước khi nhuộm là rất quan trọng
Bất kỳ bác sĩ bệnh lý, quản lý phòng thí nghiệm hoặc kỹ thuật viên hóa mô nào cũng sẽ dễ dàng thừa nhận rằng việc chuẩn bị cho nhuộm hóa mô miễn dịch (IHC) bắt đầu ngay từ lúc mẫu mô được thu thập. Tài liệu nghiên cứu đã ghi nhận các điều kiện tối ưu cho việc cố định mô, xử lý và cắt lát nhằm đảm bảo rằng hình thái và khả năng kháng nguyên được duy trì. Hơn nữa, những cải tiến trong việc duy trì tính nhất quán để kiểm soát đúng các yếu tố này có thể được thực hiện. Điều này có thể liên quan đến việc thiết lập phòng thí nghiệm ngay tại nơi thu thập, nhận ra rằng việc tiếp nhận và chuẩn bị mẫu bắt đầu từ đây.
Hệ thống tiếp nhận tự động, hệ thống thông tin phòng thí nghiệm (LIS) và cơ sở hạ tầng theo dõi mẫu nên mở rộng ra ngoài phòng thí nghiệm và vào khu phẫu thuật/điểm sinh thiết, cho phép các thiết bị chuẩn hóa cho việc chuẩn bị được theo dõi để đảm bảo xử lý tối ưu trong các bước tiếp theo. Một ngành công nghiệp song song đã nhận ra giá trị này là phòng thí nghiệm phân tích máu, sử dụng các ống thu thập có lớp phủ chuẩn hóa với thông tin bệnh nhân có mã vạch để theo dõi và tiếp nhận.
Liên kết việc cố định, xử lý mô và nhuộm IHC sẽ gia tăng giá trị kiểm soát chất lượng. Các phòng thí nghiệm có thể giám sát và ghi lại các điều kiện cố định và xử lý mô, đồng thời liên kết chúng với các quy trình nhuộm IHC sẽ có khả năng báo cáo chẩn đoán trong một môi trường được kiểm soát chất lượng chặt chẽ hơn. Việc sử dụng thường xuyên các kiểm soát cho sự biến đổi trước khi xử lý (ví dụ: kiểm soát mỗi 100 lát) cũng có thể cung cấp một thước đo tốt cho dung sai và hiệu suất của thiết bị nhuộm. Các quy trình làm việc và công nghệ này sẽ phát triển khi ngành công nghiệp IHC phát triển. Tuy nhiên, có một số thực hành tốt đã được biết đến để thiết lập và duy trì chất lượng cao và kết quả nhất quán từ nhuộm IHC (tham khảo bảng bên dưới).
| Quá trình | Vị trí | Các vấn đề chung tác động đến IHC |
|---|---|---|
| Cắt bỏ/Sinh thiết | Phẫu thuật/Phòng khám bác sĩ | Tổn thương mô do thiết bị cắt
Thiếu máu và chết tế bào do chậm trễ giữa việc cắt và cố định, cũng như tỉ lệ diện tích bề mặt với lượng chất cố định Đánh dấu sai mẫu Cố định quá mức |
| Tiếp nhận mẫu | Phòng thí nghiệm | Mẫu ghi nhãn sai
Mẫu bị bỏ sót |
| Phẫu tích | Phòng thí nghiệm | Các lát cắt quá dày
Chấn thương mẫu do xử lý không đúng cách Nhiễm chéo với các trường hợp khác Loại cassette không phù hợp Cassette quá tải |
| Xử lý mô | Phòng thí nghiệm | Khử canxi kém (nếu cần)
Cố định không đầy đủ hoặc cố định quá mức Chọn lịch trình không phù hợp Thuốc thử kém chất lượng Thuốc thử nhiễm bẩn |
| Vùi mô | Phòng thí nghiệm | Mô không được đặt đúng hướng
Khuôn không phù hợp hoặc đổ đầy quá mức Tổn thương cấu trúc tế bào do xử lý thô bạo hoặc nhiệt độ quá cao Loại cassette không phù hợp Cassette quá tải |
| Vi phẫu | Phòng thí nghiệm | Dao kém chất lượng hoặc hình dạng dao không chính xác
Góc nghiêng dao không chính xác Hư hỏng do cắt lạnh Cắt vội gây ra “vết nứt” |
| Sự căng mô | Phòng thí nghiệm | Nước bẩn hoặc bị ô nhiễm
Ô nhiễm chéo do làm sạch bể không đúng cách hoặc làm nổi các lát cắt cho nhiều khối mẫu Nhiệt độ nước không chính xác Các phần cắt kéo giãn quá mức Có bọt khí hình thành bên dưới mô hoặc các phần mô bị nhấc lên Thời gian trước khi bắt đầu nhuộm |
Minh Khang là nhà phân phối và nhập khẩu trực tiếp các thiết bị Giải phẫu bệnh từ hãng Leica Biosystems.


 EN
EN