Giới thiệu
Escherichia coli (E. coli) là một loại vi khuẩn kỵ khí tùy nghi sống ở ruột non của động vật máu nóng, bao gồm cả con người. E. coli có thể được nuôi cấy dễ dàng và không tốn kém trong môi trường phòng thí nghiệm và đã trở thành một sinh vật mô hình quan trọng trong di truyền học, vi sinh học và công nghệ sinh học. E. coli là sinh vật phổ biến nhất được sử dụng để sản xuất protein điều trị quy mô lớn. Thật vậy, 30% protein điều trị đã được phê duyệt hiện đang được sản xuất bằng cách sử dụng E. coli. Ghi chú ứng dụng này sẽ trình bày về cách sử dụng thiết bị nuôi cấy vi sinh BioLector và Máy phân tích kích thước hạt Multisizser 4e Coulter để tối ưu hóa môi trường nuôi cấy E. coli và mô tả đặc điểm tăng trưởng tế bào.
Giám sát điều kiện nuôi cấy tế bào tối ưu
Thiết bị nuôi cấy vi sinh BioLector là hệ thống tự động hóa quy mô nhỏ cho phép sàng lọc thông lượng cao, theo dõi thông số nuôi cấy (ví dụ, độ pH, sinh khối, độ bão hòa oxy, tốc độ lắc và cường độ huỳnh quang) và tối ưu hóa quy trình bổ sung chất dinh dưỡng. Điều quan trọng là tất cả các thông số này đều được theo dõi trực tuyến mà không cần phải dừng lắc hoặc lấy mẫu. Trong ví dụ này, thiết bị BioLector được sử dụng để xác định quy trình bổ sung chất dinh dưỡng cho các nuôi cấy E. coli theo mẻ.
Phương pháp
Nuôi cấy E. coli (kiểu tự nhiên BL21) được thực hiện trong thiết bị nuôi cấy vi sinh BioLector, sử dụng đĩa vi mô FlowerPlate 32 giếng vi lưu M2P-MTP-MF32-BOH1. Đĩa này được trang bị hai đầu dò quang chuẩn để theo dõi trực tuyến quang học độ pH (phạm vi 5-7) và oxy hòa tan (DO). Một môi trường nuôi cấy trước trong môi trường canh thang (TB) đã được chuẩn bị (mật độ quang ban đầu = 0,1) ở 37°C trong bình lắc 250 mL ở tốc độ 250 vòng/phút trong 6 giờ. Ngoài ra, hai hỗn hợp chính của môi trường tối thiểu Wilms MOPS với 20 g/L glucose và 10 g/L glycerol đã được sử dụng cho nuôi cấy chính trong thiết bị (mật độ quang ban đầu = 0,1). Thể tích nuôi cấy trong đĩa vi mô là 800-1200 μL mỗi giếng. Đĩa được lắc ở tốc độ 1200 vòng/phút ở 37°C, mức độ ẩm được đặt ở mức 75%. Chất điều chỉnh pH được sử dụng là NaOH 3M. Dung dịch nuôi cấy bao gồm 10 mL dung dịch glycerol (glycerol 500 g/L) và 2 mL nguồn nitơ (250 g/L (NH4)2SO4, 25 g/L NH4Cl). Hai phương thức nuôi cấy khác nhau đã được sử dụng: nuôi cấy kích hoạt DO và nuôi cấy liên tục. Trong phương thức nuôi cấy kích hoạt DO, MTP được thiết lập để cung cấp xung 4 μL dung dịch nuôi cấy khi DO giảm xuống dưới 30% lần đầu tiên để kích hoạt và sau đó bất cứ khi nào DO cao hơn 70% trong quá trình nuôi cấy. Trong phương thức nuôi cấy liên tục, MTP được thiết lập để cung cấp 3 μL/giờ dung dịch nuôi cấy trong quá trình nuôi cấy.
Kết quả và thảo luận
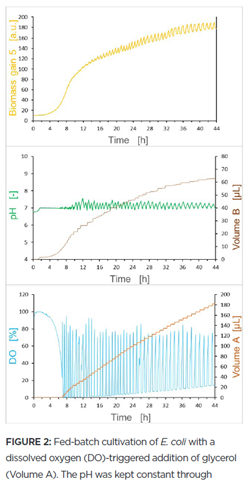
Hình 2 thể hiện kết quả của thí nghiệm bổ sung chất dinh dưỡng kích hoạt DO. Biểu đồ trên cho thấy mức tăng sinh khối trong 44 giờ; biểu đồ ở giữa cho thấy thể tích của tác nhân điều chỉnh pH (Khối lượng B) và quá trình pH tương ứng; biểu đồ dưới cho thấy mức DO và thể tích chất bổ sung glycerol (Khối lượng A).
Nhìn chung, kết quả cho thấy rằng khi bắt đầu nuôi cấy, số lượng tế bào thấp và do đó DO xấp xỉ 100%. Tiếp theo, lượng oxy tiêu thụ tăng cùng với sự phát triển của tế bào và do đó, mức DO giảm. Pha tĩnh bắt đầu sau khoảng 7 giờ. Khi DO giảm xuống dưới 30% lần đầu tiên, hệ thống cung cấp một xung 4 μL dung dịch nuôi cấy để kích hoạt. Trong pha này, tốc độ tăng trưởng của nuôi cấy chậm đã được quan sát thấy, tương quan với mức tiêu thụ oxy thấp và sự gia tăng nhanh chóng của DO. Tiếp theo, khi DO đạt 70%, một xung nuôi cấy mới được cung cấp và do đó, tốc độ tăng trưởng lại tăng lên. Chu kỳ này được lặp lại trong suốt quá trình thí nghiệm. Do đó, đường cong nuôi cấy cho thấy sự gia tăng theo từng bước phụ thuộc vào sự biến động của DO, tác động của nó cũng được quan sát thấy trong tín hiệu sinh khối. Do sự bổ sung liên tục của glycerol và sự phát triển của vi khuẩn có liên quan, nuôi cấy tạo ra axetat. Điều này dẫn đến sự giảm giá trị pH phụ thuộc vào sự tăng trưởng (Hình 2, biểu đồ ở giữa). Do đó, thể tích chất điều chỉnh pH (Thể tích B trong Hình 2) tăng theo sự phát triển của nuôi cấy.
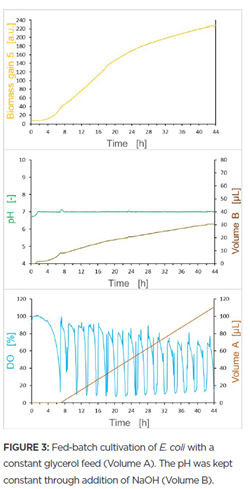
Hình 3 cho thấy các biến số tương tự được đo khi nuôi cấy nhận được chất bổ sung glycerol không đổi (3 μL/h) sau khi nuôi cấy đạt đến pha tĩnh (khoảng 7 giờ). Phương thức bổ sung chất dinh dưỡng liên tục dẫn đến ít biến động hơn về mức DO so với phương thức xung kích hoạt DO. Do đó, cả sự phát triển của nuôi cấy và giá trị pH cũng cho thấy ít biến động hơn. Có thể kết luận rằng sự phát triển sinh khối có biểu hiện khác nhau tùy thuộc vào quy trình bổ sung chất dinh dưỡng. Lượng sinh khối tăng cuối cùng cao hơn khi phương thức này không đổi, ngay cả khi nuôi cấy nhận được tổng thể tích dung dịch chất bổ sung nhỏ hơn. Hơn nữa, vì phương thức bổ sung liên tục dẫn đến hầu như không có biến động nào về mức pH nên cần tổng thể tích chất điều chỉnh pH nhỏ hơn. Do đó, có thể khuyến nghị bổ sung chất dinh dưỡng liên tục để tối ưu hóa nuôi cấy E. coli.
Tóm lại, thiết bị nuôi cấy vi sinh BioLector lý tưởng cho các quy trình nuôi cấy vi khuẩn theo từng mẻ (fed-batch) và có thể được sử dụng để tối ưu hóa các điều kiện nuôi cấy vi khuẩn. Có thể thực hiện tối đa 32 lần nuôi cấy fed-batch được kiểm soát pH trong một thí nghiệm cùng một lúc. Lắc liên tục trong quá trình đo đảm bảo truyền khối liên tục và đồng nhất hóa các tế bào lơ lửng. Thiết bị nuôi cấy vi sinh BioLector không chỉ cho phép đo trực tuyến sinh khối, độ pH và oxy hòa tan mà còn điều chỉnh giá trị pH và cung cấp dung dịch dinh dưỡng theo tín hiệu.
Các nghiên cứu trước đây đã chỉ ra hiệu quả của thiết bị nuôi cấy vi sinh BioLector trong việc sàng lọc các điều kiện nuôi cấy E. coli tối ưu trước khi mở rộng quy mô. Hệ thống cho phép đánh giá và phân biệt các nền nuôi cấy khác nhau, cải thiện các điều kiện sàng lọc, phát triển quy trình và quy trình mở rộng quy mô.
Theo dõi sự phát triển của tế bào
Kích thước tế bào là một thông số quan trọng được sử dụng để hiểu rõ hơn về sự đa dạng của các cơ chế tế bào (ví dụ, chu kỳ tế bào, điều hòa thẩm thấu, tế bào chết, sinh bệnh, thực bào, sự đa dạng loài, v.v.). Thiết bị Multisizer 4e sử dụng phương pháp Coulter để phát hiện các hạt từ 200 nm đến 1.600 μm bất kể bản chất hoặc tính chất quang học của hạt. Các hạt lơ lửng trong dung dịch điện phân 0,9% được kéo qua một lỗ hình trụ nhỏ. Hai điện cực chìm nằm ở mỗi bên của lỗ tạo ra dòng điện. Khi mỗi hạt đi qua lỗ, nó sẽ đẩy thể tích chất lỏng dẫn điện của chính nó, làm tăng tạm thời trở kháng của lỗ. Điều này tạo ra xung điện áp tỷ lệ thuận với thể tích của hạt. Số xung điện biểu thị số lượng hạt, trong khi biên độ của xung điện được tạo ra phụ thuộc vào thể tích của hạt. Trong ví dụ sau, thiết bị Multisizer 4e đã được sử dụng để mô tả kích thước tế bào trong nuôi cấy E. coli.
Phương pháp
Một mẫu nuôi cấy E. coli được pha loãng trước theo tỷ lệ 1:1000 với Isoton 2 trong Accuvete ST 10 mL. Từ dung dịch pha loãng này, 50 μL được sử dụng cho mỗi phép đo. Khẩu độ được sử dụng là 20 μm và mỗi phép đo kéo dài 36 giây. Danh sách đầy đủ các thiết lập được hiển thị trong Bảng 1. Dữ liệu được tạo ra được xử lý bằng công nghệ Digital Pulse Processing (DPP). DPP cho phép thu thập, lưu trữ và hiển thị từng xung riêng lẻ. Điều này có nghĩa là các vùng riêng lẻ của phổ xung có thể được đánh giá riêng biệt vào một ngày sau đó.
Kết quả và thảo luận
Dữ liệu DPP của thí nghiệm cho thấy kích thước của vi khuẩn E. coli trong nuôi cấy này dao động từ 0,4 đến 2,2 μm (Hình 4).
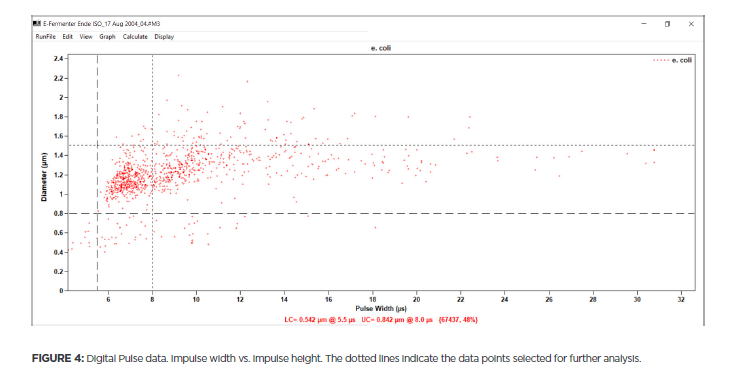
Từ dữ liệu này, có thể chọn một phạm vi quan tâm (các đường chấm trong hình 4) và tạo các biểu đồ tần suất khác nhau (tức là số lượng tế bào cho mỗi thể tích). Ví dụ, hình 5 hiển thị biểu đồ kết quả nếu chọn phạm vi từ 0,8 đến 1,5 μm.
Công nghệ DPP cung cấp độ phân giải và độ chính xác cực cao (tức là phát hiện 1 hạt trong 1 mL mẫu), điều mà các công nghệ hiện tại khác không thể đạt được. Do đó, nó có thể được sử dụng để xác định chính xác thể tích, số lượng và nồng độ tế bào và phát hiện những thay đổi kích thước theo thời gian thực trong quá trình nuôi cấy. Ví dụ, các nghiên cứu khác nhau đã sử dụng công cụ này để mô tả động lực tăng trưởng của E. coli và khả năng tăng trưởng. Thiết bị Multisizer cũng đã được sử dụng để nghiên cứu sự phụ thuộc của tốc độ tăng trưởng vào kích thước tế bào của các nuôi cấy E. coli trong các điều kiện dinh dưỡng khác nhau. Trong điều kiện bình thường, tốc độ tăng trưởng của E. coli có mối tương quan tích cực với kích thước tế bào (tức là các tế bào lớn phát triển nhanh hơn). Tuy nhiên, nghiên cứu này phát hiện ra rằng khi chất dinh dưỡng khan hiếm, sự biểu hiện quá mức protein sẽ đảo ngược mối quan hệ này và dẫn đến các tế bào lớn có tốc độ tăng trưởng thấp. Phát hiện này cho thấy vai trò quan trọng của quá trình tổng hợp protein trong việc kiểm soát phân chia tế bào trong nuôi cấy E. coli.
Phần kết luận
Máy vi sinh BioLector và thiết bị Multisizer 4e là những thiết bị để bàn có giao diện người dùng trực quan, có thể tích hợp vào bất kỳ phòng thí nghiệm nào để tối ưu hóa và theo dõi nuôi cấy vi khuẩn E. coli cho nhiều ứng dụng khác nhau.
Minh Khang là nhà phân phối và nhập khẩu trực tiếp các Thiết bị nuôi cấy vi sinh & Phân tích kích thước hạt hãng Beckman Coulter.



 EN
EN