Giới thiệu
Theo dõi hình ảnh chuyển động của tế bào sống theo phương pháp truyền thống bằng cách sử dụng các kỹ thuật tăng cường độ tương phản phổ biến bao gồm trường sáng, độ tương phản nhiễu vi sai (DIC), độ tương phản điều biến Hoffman (HMC), tương phản pha và huỳnh quang trường rộng. Tuy nhiên, các kỹ thuật mới hiện nay không chỉ đơn giản là tạo ra chuỗi các ảnh về cấu trúc và chức năng của tế bào, mà còn cho phép tua nhanh hình ảnh được tích hợp với các chế độ chuyên biệt để theo dõi, đo lường và gây nhiễu các hoạt động động của mô, tế bào, và các cấu trúc dưới tế bào.
Phần lớn các cuộc nghiên cứu hình ảnh tế bào sống được thực hiện với các tế bào động vật có vú có độ dày từ 10 micromet. Tuy nhiên, các nhà nghiên cứu đang ngày càng chú ý đến các mẫu mô động vật và thực vật dày hơn có thể có độ dày từ 10 đến 200 micromet. Trong hầu như tất cả các tình huống chụp ảnh tế bào sống sử dụng kính hiển vi trường rộng, thông tin ngoài tiêu cự làm mờ hình ảnh và sự khuấy trộn liên tục của tế bào chất tạo ra những hạn chế về thời gian phơi sáng. Cả hai phương pháp trường sáng và huỳnh quang được sử dụng để chụp ảnh các mô động vật và thực vật mỏng cũng như dày hơn đều phải tính đến độ nhạy của các mẫu vật này khi tiếp xúc với ánh sáng và các vấn đề liên quan đến việc giải quyết các đặc điểm nằm trên 20 đến 30 micromet trong mẫu vật.
Các kỹ thuật trường sáng thường ít gây hại hơn cho các tế bào sống, nhưng phương pháp quan sát các protein cụ thể bằng cách sử dụng ánh sáng truyền qua chưa được phát triển rộng rãi. Việc tạo ra sự khác biệt về cường độ hoặc màu sắc có độ tương phản cao trong hình ảnh trường sáng khó hơn việc xác định sự thay đổi cường độ sáng (thực chất là do huỳnh quang) trên nền tối hoặc đen. Do đó, các kỹ thuật trường sáng tìm thấy các ứng dụng trong việc theo dõi các bào quan hoặc phát hiện trên toàn tế bào, trong khi các phương pháp huỳnh quang, bao gồm các kỹ thuật đồng tiêu, thường được sử dụng để theo dõi các phân tử cụ thể.
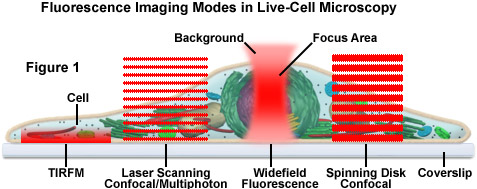
Trình bày trong Hình 1 là một sơ đồ minh họa các chế độ hình ảnh phổ biến trong chế độ quét và trường rộng của kính hiển vi huỳnh quang. Các kỹ thuật trường rộng, quét laser, đĩa quay và đa điểm sử dụng các chiến lược phát hiện và chiếu sáng rất khác nhau để tạo ảnh. Sơ đồ minh họa một tế bào động vật có vú bám dính trên một lớp phủ được chiếu sáng bằng phản xạ toàn phần bên trong (TIRFM), quét laze, đa photon và tiêu điểm đĩa quay, ngoài huỳnh quang trường rộng truyền thống. Các mẫu phát hiện cho từng kỹ thuật được biểu thị bằng lớp phủ màu đỏ. Trong trường rộng, mẫu vật được chiếu sáng khắp trường cũng như bên trên và bên dưới mặt phẳng tiêu điểm. Mỗi nguồn điểm được trải thành một hình giống như một hình nón đảo ngược được gọi là hàm trải điểm (PSF). Chỉ phần trung tâm của hình dạng này nằm trong mặt phẳng tiêu cự với phần còn lại góp phần tạo ra hiện tượng mờ ngoài tiêu điểm, làm giảm chất lượng hình ảnh.
Ngược lại, các kính hiển vi đồng tiêu quét laze, đa photon và đĩa quay quét mẫu vật bằng đèn phóng điện hồ quang hoặc laze hội tụ chặt chẽ (đĩa quay). Mô hình kích thích là một chức năng trải điểm, nhưng một lỗ kim liên hợp trong đường quang của kính hiển vi đồng tiêu ngăn không cho huỳnh quang phát ra từ mặt phẳng tiêu điểm tác động đến bộ nhân quang hoặc máy dò máy ảnh kỹ thuật số. Kính hiển vi đồng tiêu quét laze có một điểm laze hội tụ duy nhất được quét qua mẫu vật. Trong kính hiển vi đĩa quay, một dãy các khe hở, trong một số trường hợp được gắn các phần tử thấu kính siêu nhỏ, được đặt trên một đĩa quay sao cho các lỗ này nhanh chóng quét qua mẫu vật và tạo ra hình ảnh được ghi lại bằng máy ảnh kỹ thuật số. Trong kính hiển vi đa photon, vùng mà tại đó thông lượng photon đủ cao để kích thích các huỳnh quang có nhiều hơn một photon nằm ở vị trí đúng nét của chức năng trải điểm. Do đó, kích thích fluorophore chỉ xảy ra trong tiêu điểm. Bởi vì tất cả huỳnh quang phát ra từ các huỳnh quang đúng tiêu điểm, không cần lỗ kim và huỳnh quang phát ra tạo ra hình ảnh sắc nét, đúng tiêu điểm.
Kính hiển vi huỳnh quang và kỹ thuật truyền sáng
Một trong những kỹ thuật chính được sử dụng trong tất cả các dạng kính hiển vi huỳnh quang là trường sáng chiếu sáng dựa trên những thay đổi về độ hấp thụ ánh sáng, chỉ số khúc xạ hoặc màu sắc để tạo ra độ tương phản. Khi ánh sáng đi qua mẫu vật, các vùng làm thay đổi hướng, tốc độ và/hoặc quang phổ của mặt sóng tạo ra sự chênh lệch huỳnh quang (độ tương phản) khi các tia được vật kính hội tụ và hội tụ. Độ phân giải trong hệ thống trường sáng phụ thuộc vào cả khẩu độ số của vật kính và tụ quang, và môi trường ngâm thường được yêu cầu ở cả hai mặt của mẫu vật (đối với các tổ hợp khẩu độ số vượt quá giá trị 1,0). Máy ảnh kỹ thuật số cung cấp dải động rộng và độ phân giải không gian cần thiết để nắm bắt thông tin có trong hình ảnh trường sáng. Ngoài ra, các thuật toán trừ nền, sử dụng các khung lấy trung bình được chụp mà không có mẫu vật trong đường dẫn huỳnh quang làm tăng độ tương phản đáng kể.
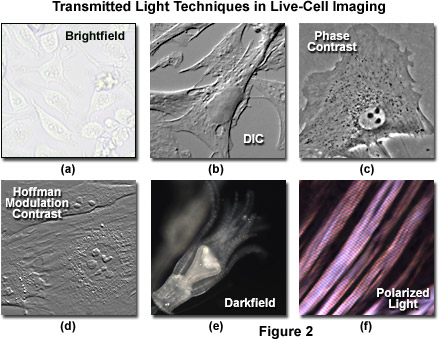
Hình ảnh trường sáng đơn giản, với kính hiển vi được điều chỉnh phù hợp để chiếu sáng Köhler (xem Hình 2(a)), cung cấp một lượng thông tin hạn chế về đường viền tế bào, vị trí hạt nhân và vị trí của các túi lớn hơn. Tuy nhiên, việc thiếu độ tương phản chung trong chế độ trường sáng khiến kỹ thuật này tương đối vô dụng đối với các nghiên cứu nghiêm túc về cấu trúc và chức năng của tế bào. Các phương pháp tăng cường độ tương phản bao gồm độ tương phản nhiễu vi sai (DIC), ánh sáng phân cực, độ tương phản pha, độ tương phản điều chế Hoffman và kính hiển vi trường tối (các ví dụ được minh họa trong Hình 2). Một số kỹ thuật trong số này bị giới hạn bởi ánh sáng bắt nguồn từ các vùng bị loại bỏ khỏi mặt phẳng tiêu điểm khi chụp ảnh các mô động vật và thực vật dày hơn, trong khi ánh sáng phân cực yêu cầu tính lưỡng chiết (thường không xuất hiện ở mức độ đáng kể trong tế bào động vật) để tạo ra độ tương phản. Các tế bào buồng trứng của chuột đồng Trung Quốc kết dính được trình bày trong Hình 2(a) được tạo ảnh trong điều kiện chiếu sáng trường sáng mà không có sự hỗ trợ của phương pháp tăng cường độ tương phản huỳnh quang. Lưu ý sự thiếu tương phản chung khi so sánh với các hình ảnh khác trong hình. Các tế bào riêng lẻ rất khó phân biệt và hầu hết các tính năng bên trong (ví dụ: hạt nhân) không hiển thị trong hình ảnh này.
Sự tương phản chênh lệch của kính hiển vi (Hình 2(b) và Hình 3(a)) yêu cầu ánh sáng phân cực phẳng và các lăng kính cắt ánh sáng bổ sung (Nomarski hoặc Wollaston) để phóng đại sự khác biệt nhỏ về độ dốc độ dày mẫu vật và chỉ số khúc xạ. Ví dụ, hai lớp lipid tạo ra độ tương phản tuyệt vời trong DIC do sự khác biệt về chỉ số khúc xạ giữa các pha nước và lipid của tế bào. Ngoài ra, ranh giới tế bào trong các tế bào thực vật và động vật có vú tương đối phẳng, bao gồm màng sinh chất, nhân, không bào, ty thể và các sợi ứng suất, thường tạo ra độ dốc đáng kể, dễ dàng được tạo ảnh bằng DIC. Trong các mô thực vật, thành tế bào lưỡng chiết làm giảm độ tương phản trong DIC ở một mức độ hạn chế, nhưng một hệ thống được căn chỉnh phù hợp sẽ cho phép hình dung màng nhân và màng không bào, ty thể, lục lạp, và nhiễm sắc thể ngưng tụ trong các tế bào biểu bì. Độ tương phản giao thoa vi sai là một kỹ thuật quan trọng để chụp ảnh các mô động vật và thực vật dày vì ngoài độ tương phản tăng lên, DIC còn thể hiện độ sâu tiêu cự giảm ở khẩu độ rộng, tạo ra tiết diện huỳnh quang mỏng của mẫu vật dày. Hiệu ứng này cũng thuận lợi cho việc chụp ảnh các tế bào kết dính để giảm thiểu hiện tượng mờ phát sinh từ các mảnh vụn trôi nổi trong môi trường nuôi cấy.
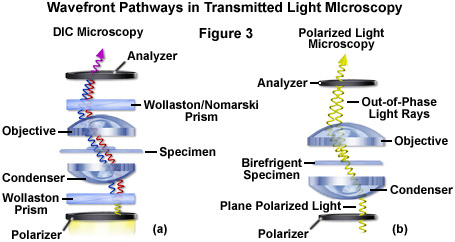
Ánh sáng phân cực của kính hiển vi (Hình 2(f) và Hình 3(b)) được tiến hành bằng cách xem mẫu giữa các phần tử phân cực chéo. Các tập hợp bên trong tế bào có đặc tính lưỡng chiết, chẳng hạn như thành tế bào thực vật, hạt tinh bột và thoi phân bào, cũng như mô cơ, làm quay mặt phẳng phân cực ánh sáng, xuất hiện sáng trên nền tối. Mô cơ thỏ được minh họa trong Hình 2(f) là một ví dụ về kính hiển vi ánh sáng phân cực được áp dụng để quan sát mô sống. Lưu ý rằng kỹ thuật này bị hạn chế bởi sự xuất hiện lưỡng chiết suất hiếm gặp trong các tế bào và mô sống và vẫn chưa được khám phá đầy đủ. Như đã đề cập ở trên, độ tương phản giao thoa vi sai hoạt động bằng cách đặt một cặp lăng kính Nomarski đối nhau phù hợp giữa các bản phân cực chéo,
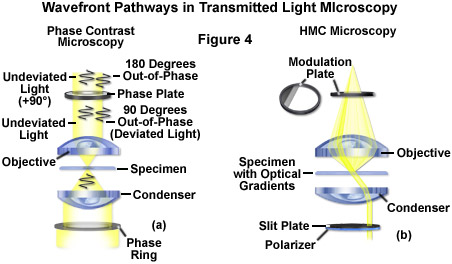
Độ tương phản pha phổ biến rộng rãi (như được minh họa trong Hình 2(c) và Hình 4(a)) sử dụng một cơ chế huỳnh quang để dịch các biến thiên nhỏ về pha thành các thay đổi biên độ tương ứng, có thể được hình dung như là sự khác biệt về độ tương phản của hình ảnh. Kính hiển vi phải được trang bị một tụ quang chuyên dụng chứa một loạt các vòng khuyên phù hợp với một bộ vật kính chứa các vòng pha ở mặt phẳng tiêu điểm phía sau (các vật kính tương phản pha cũng có thể được sử dụng với huỳnh quang, nhưng độ truyền qua giảm đi một chút). Tương phản pha là một phương pháp tuyệt vời để tăng độ tương phản khi xem hoặc chụp ảnh các tế bào sống trong quá trình nuôi cấy, nhưng thường dẫn đến các quầng sáng quá mức xung quanh đường viền của các đặc điểm cạnh. Những vầng hào quang này là tạo tác huỳnh quang thường làm giảm khả năng hiển thị của các chi tiết ranh giới. Kỹ thuật này không hữu ích đối với các mẫu vật dày (chẳng hạn như các phần mô thực vật và động vật) vì sự lệch pha xảy ra ở các vùng bị loại khỏi mặt phẳng tiêu điểm làm biến dạng chi tiết hình ảnh. Hơn nữa, các mảnh vụn trôi nổi và các vật thể nằm ngoài tiêu điểm khác cản trở việc tạo ảnh các tế bào bám dính trên nắp trượt.
Thường được gọi một cách ẩn dụ là “poor man’s DIC”, độ tương phản điều chế Hoffman là một kỹ thuật chiếu sáng xiên giúp tăng cường độ tương phản trong các tế bào và mô sống bằng cách phát hiện các gradient huỳnh quang (xem Hình 2(d) và Hình 4(b)). Cấu hình cơ bản của kính hiển vi bao gồm một bộ lọc không gian biên độ huỳnh quang, được gọi là bộ điều biến, được lắp vào mặt phẳng tiêu cự phía sau của vật kính. Cường độ ánh sáng đi qua bộ biến điệu thay đổi trên và dưới giá trị trung bình, theo định nghĩa, khi đó được cho là đã điều chế. Kết hợp với bộ điều biến vật kính là một khe hở ngoài trục được đặt trong mặt phẳng tiêu cự phía trước của tụ quang để hướng ánh sáng xiên về phía mẫu vật. Không giống như tấm pha trong kính hiển vi tương phản pha, bộ biến điệu Hoffman được thiết kế để không làm thay đổi pha của ánh sáng đi qua; thay vào đó, nó ảnh hưởng đến cực đại bậc 0 chính để tạo ra độ tương phản. Độ tương phản điều chế Hoffman không bị cản trở bởi việc sử dụng các vật liệu lưỡng chiết (chẳng hạn như đĩa Petri bằng nhựa) trong đường dẫn huỳnh quang, vì vậy kỹ thuật này hữu ích hơn để kiểm tra mẫu vật trong các vật chứa được chế tạo bằng vật liệu polyme. Về mặt nhược điểm,
 Phương pháp trường tối của kính hiển vi, mặc dù được áp dụng rộng rãi để chụp ảnh các mẫu vật trong suốt trong suốt thế kỷ 19 và 20, nhưng bị hạn chế sử dụng cho các tế bào và sinh vật bị cô lập về mặt vật lý (như được trình bày trong Hình 2(e)). Trong kỹ thuật này, tụ quang hướng một hình nón ánh sáng vào mẫu vật ở các góc phương vị cao sao cho các mặt sóng bậc một không đi trực tiếp vào thành phần thấu kính phía trước vật kính. Ánh sáng đi qua mẫu vật bị nhiễu xạ, phản xạ và/hoặc khúc xạ bởi sự gián đoạn quang học (chẳng hạn như màng tế bào, nhân và các bào quan bên trong) cho phép các tia yếu này đi vào vật kính. Mẫu vật sau đó có thể được hình dung như một vật thể sáng trên nền đen. Thật không may, ánh sáng tán xạ bởi các vật thể bị loại bỏ khỏi mặt phẳng tiêu cự cũng góp phần tạo nên hình ảnh, do đó làm giảm độ tương phản và che khuất chi tiết mẫu vật. Hiện tượng này được kết hợp bởi thực tế là bụi và mảnh vụn trong buồng tạo ảnh cũng góp phần đáng kể vào hình ảnh thu được. Hơn nữa, các tế bào kết dính mỏng thường chịu tín hiệu rất yếu, trong khi các mô thực vật và động vật dày chuyển hướng quá nhiều ánh sáng vào đường dẫn mục tiêu, làm giảm hiệu quả của kỹ thuật.
Phương pháp trường tối của kính hiển vi, mặc dù được áp dụng rộng rãi để chụp ảnh các mẫu vật trong suốt trong suốt thế kỷ 19 và 20, nhưng bị hạn chế sử dụng cho các tế bào và sinh vật bị cô lập về mặt vật lý (như được trình bày trong Hình 2(e)). Trong kỹ thuật này, tụ quang hướng một hình nón ánh sáng vào mẫu vật ở các góc phương vị cao sao cho các mặt sóng bậc một không đi trực tiếp vào thành phần thấu kính phía trước vật kính. Ánh sáng đi qua mẫu vật bị nhiễu xạ, phản xạ và/hoặc khúc xạ bởi sự gián đoạn quang học (chẳng hạn như màng tế bào, nhân và các bào quan bên trong) cho phép các tia yếu này đi vào vật kính. Mẫu vật sau đó có thể được hình dung như một vật thể sáng trên nền đen. Thật không may, ánh sáng tán xạ bởi các vật thể bị loại bỏ khỏi mặt phẳng tiêu cự cũng góp phần tạo nên hình ảnh, do đó làm giảm độ tương phản và che khuất chi tiết mẫu vật. Hiện tượng này được kết hợp bởi thực tế là bụi và mảnh vụn trong buồng tạo ảnh cũng góp phần đáng kể vào hình ảnh thu được. Hơn nữa, các tế bào kết dính mỏng thường chịu tín hiệu rất yếu, trong khi các mô thực vật và động vật dày chuyển hướng quá nhiều ánh sáng vào đường dẫn mục tiêu, làm giảm hiệu quả của kỹ thuật.
Kính hiển vi huỳnh quang trường rộng
Trong các ứng dụng chụp ảnh tế bào sống, kính hiển vi huỳnh quang trường rộng rất hữu ích để quan sát động lực học của các tế bào kết dính phát triển trong các buồng môi trường chuyên biệt thích ứng với giai đoạn kính hiển vi. Ở cấu hình thô sơ nhất, kính hiển vi nuôi cấy mô đảo ngược tiêu chuẩn được trang bị chiếu sáng huỳnh quang epi được kết hợp với hệ thống máy ảnh CCD, bộ lọc huỳnh quang thích hợp và hệ thống màn trập để hạn chế sự phơi nhiễm quá mức của tế bào với ánh sáng kích thích có hại. Kính hiển vi huỳnh quang cơ bản dựa vào các bộ lọc nhiễu phù hợp cẩn thận trong việc lựa chọn băng thông cụ thể để chiếu sáng và phát hiện phát xạ. Các nguồn sáng bao gồm đèn hồ quang thủy ngân, xenon và halogen kim loại, hệ thống laze mở rộng chùm tia và điốt phát quang (LED), tất cả đều yêu cầu các thông số kỹ thuật bộ lọc khác nhau. Các huỳnh quang tổng hợp hữu ích trong kính hiển vi huỳnh quang có phổ phát xạ bao phủ các vùng cận tử ngoại, khả kiến và cận hồng ngoại. Việc áp dụng các protein huỳnh quang được mã hóa di truyền đã mở rộng đáng kể khả năng chụp ảnh tế bào sống trong kính hiển vi huỳnh quang bằng cách cho phép các nhà điều tra nhắm mục tiêu vào các vùng quan tâm dưới tế bào với độ chính xác chính xác.
Trong huỳnh quang trường rộng, độ mở đầy đủ của ánh sáng phát xạ được thu thập bởi vật kính của kính hiển vi sẽ tối đa hóa tín hiệu được ghi lại và đồng thời giảm thiểu thời gian phơi sáng cần thiết. Do đó, các mẫu vật có thể được chụp ảnh với thời gian chiếu sáng rất ngắn. Hạn chế chính đối với hình ảnh trường rộng là huỳnh quang phát sinh từ các vùng cách xa mặt phẳng tiêu cự, cũng như tín hiệu nền, tạo ra ánh sáng không hữu ích thường che khuất các đặc điểm quan tâm. Có rất nhiều mẫu tế bào sống, bao gồm các tế bào kết dính, vi khuẩn, nấm men và các phần mô rất mỏng, là những mẫu lý tưởng để tạo ảnh trong huỳnh quang trường rộng.
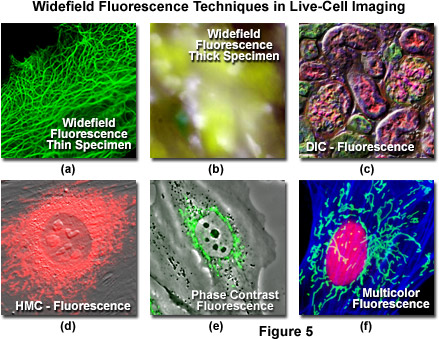
Mặc dù đã có nhiều tiến bộ trong việc phát triển thuốc nhuộm huỳnh quang tổng hợp, chấm lượng tử và protein huỳnh quang để chụp ảnh ở chế độ huỳnh quang, nhưng trong một số trường hợp, việc kết hợp huỳnh quang với các phương thức chụp ảnh khác là thuận lợi. Ví dụ, kính hiển vi DIC có thể được sử dụng cùng với huỳnh quang trường rộng (Hình 5(c)) để theo dõi khả năng tồn tại của tế bào và hình thái chung đồng thời điều tra các hiện tượng quan tâm với các mục tiêu được dán nhãn cụ thể. Chụp DIC và huỳnh quang trong một khung hình duy nhất thường không thực tế, nhưng trong kính hiển vi được cấu hình phù hợp, hai kỹ thuật này có thể được sử dụng tuần tự. Do đó, hình ảnh DIC có thể được chụp từ một mẫu được dán nhãn huỳnh quang bằng cách sử dụng ánh sáng truyền qua, sau đó là hình ảnh ở chế độ huỳnh quang epi. Hai hình ảnh có thể được kết hợp trong quá trình phân tích. Các cấu hình kính hiển vi trường rộng tiên tiến có thể chụp đồng thời hình ảnh DIC và huỳnh quang bằng cách sử dụng hệ thống chiếu sáng được phân tách bằng quang phổ (như khả kiến và cận hồng ngoại) và máy ảnh kép hoặc bộ điều hợp máy ảnh có chế độ xem tách. Trong hầu hết các kính hiển vi đồng tiêu quét laze (thảo luận bên dưới), hình ảnh có thể được thu nhận đồng thời ở chế độ huỳnh quang và DIC, do đó loại bỏ nhu cầu xử lý sau thu nhận. Độ tương phản pha và độ tương phản điều chế Hoffman (Hình 5(d) và 5(e)) cũng có thể được sử dụng thành công khi kết hợp với kính hiển vi huỳnh quang trường rộng. Tuy nhiên, trong các kỹ thuật này, các vật kính được sửa đổi trực tiếp, bằng vòng pha hoặc tấm điều chế Hoffman, điều này sẽ dẫn đến mất cường độ phát xạ lên tới 5-15 phần trăm.
Một lưu ý là khi kết hợp DIC, độ tương phản pha hoặc độ tương phản điều chế Hoffman với huỳnh quang, đặc biệt là trong chụp ảnh tế bào sống, ánh sáng phát xạ truyền qua máy phân tích DIC, vòng pha vật kính hoặc tấm điều chế Hoffman ở phía sau sẽ bị mất đi. Trong trường hợp trước, máy phân tích DIC và lăng kính Nomarski phải được loại bỏ khỏi đường chùm tia trước khi chụp ảnh huỳnh quang, nhưng vật kính pha và vật kính Hoffman chứa các thành phần quang đã sửa đổi không thể loại bỏ được. Sự mất ánh sáng truyền qua vòng pha hoặc bộ biến điệu Hoffman không đáng kể bằng sự mất ánh sáng qua bộ phân cực. Tuy nhiên, các mẫu vật được nhuộm huỳnh quang kém, việc tăng độ nhạy bằng cách sử dụng các vật kính có độ truyền sáng cao là rất quan trọng
Minh họa trong Hình 5 là một loạt ảnh được chụp bằng kính hiển vi huỳnh quang trường rộng, hoặc kết hợp với một số kỹ thuật ánh sáng truyền qua được mô tả ở trên. Các tế bào ung thư biểu mô người sống (dòng HeLa) thể hiện sự kết hợp của protein huỳnh quang màu xanh lá cây tăng cường (EGFP) hợp nhất với cytokeratin của con người được thể hiện trong Hình 5(a). Các tế bào HeLa kết dính có độ dày khoảng 3 đến 5 micromet và luôn được lấy nét trong suốt hình ảnh. Ngược lại, các mẫu mô dày (dạ dày chuột; Hình 5(b)) rất khó phân giải trong huỳnh quang trường rộng do sự đóng góp của các cấu trúc huỳnh quang không nằm trong mặt phẳng tiêu cự của kính hiển vi. Huỳnh quang trường rộng có thể được sử dụng kết hợp với nhiều kỹ thuật ánh sáng truyền qua, bao gồm DIC (phần mỏng thận chuột; Hình 5(c)), tương phản điều chế Hoffman (tế bào chuột phôi; Hình 5(d)) và tương phản pha (thỏ tế bào thận; Hình 5(e)). Sử dụng kết hợp các bộ lọc nhiễu (tế bào Muntjac của Ấn Độ; Hình 5(f)).
Kính hiển vi đồng tiêu quét laze
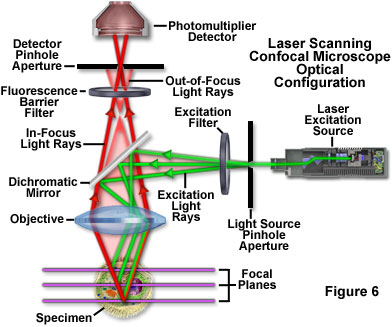
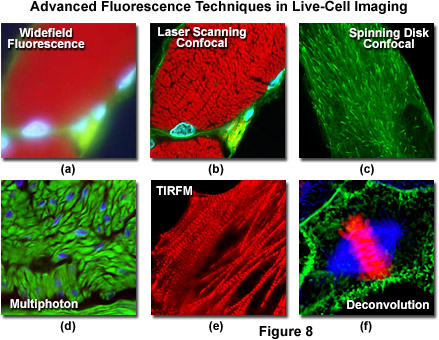
Kính hiển vi đồng tiêu quét laze mang lại một số ưu điểm so với kính hiển vi huỳnh quang trường rộng thông thường, bao gồm độ sâu trường ảnh có thể kiểm soát, loại bỏ thông tin làm giảm độ nét của hình ảnh và khả năng thu thập các phần quang học nối tiếp từ mẫu dày. Chìa khóa của phương pháp tiếp cận đồng tiêu là sử dụng bộ lọc không gian để loại bỏ ánh sáng ngoài tiêu cự hoặc lóa trong các mẫu vật dày hơn mặt phẳng tiêu điểm bằng cách chiếu sáng vật kính qua lỗ kim (xem Hình 6 và Hình 8(b)) . Hình ảnh của lỗ kim ở dạng một điểm nhỏ được hình thành trên mẫu vật bằng tia laser hội tụ được điều khiển bởi hệ thống quét dựa trên điện kế. Đến lượt nó, điểm này tạo thành hình ảnh huỳnh quang epi phản xạ trên lỗ kim ban đầu. Nếu mẫu vật được lấy nét, ánh sáng sẽ đi qua lỗ kim đến máy dò (thường là bộ nhân quang). Khi mẫu vật không được lấy nét, ánh sáng phản xạ từ nó bị mất tập trung tại lỗ kim và rất ít đi qua. Do đó, phát xạ huỳnh quang quay trở lại từ mẫu vật đến máy dò được lọc theo không gian. Khi khẩu độ lỗ kim được giảm kích thước, nó sẽ chặn được nhiều ánh sáng đi lạc hơn nhưng cũng làm giảm mức tín hiệu tổng. Mặc dù giá trị tín hiệu tuyệt đối thấp hơn nhiều so với quan sát được với cấu hình kính hiển vi trường rộng, nhưng việc loại bỏ ánh sáng từ các mặt phẳng tiêu cự khác sẽ làm tăng tỷ lệ tín hiệu trên tạp âm cụ thể cho các tính năng quan tâm.
Các ưu điểm khác của kính hiển vi quét đồng tiêu quét laze bao gồm khả năng điều chỉnh độ phóng đại bằng điện tử bằng cách thay đổi khu vực được quét bởi tia laze mà không phải thay đổi vật kính. Tính năng này được gọi là zoom và thường được sử dụng để điều chỉnh độ phân giải không gian của hình ảnh bằng cách thay đổi chu kỳ lấy mẫu laze quét. Việc tăng hệ số thu phóng sẽ làm giảm diện tích mẫu được quét và đồng thời giảm tốc độ quét. Kết quả là số lượng mẫu tăng lên dọc theo chiều dài tương đương, giúp tăng cả độ phân giải không gian hình ảnh và độ phóng đại hiển thị trên màn hình máy tính chủ. Thu phóng đồng tiêu thường được sử dụng để khớp độ phân giải hình ảnh kỹ thuật số với độ phân giải quang học của kính hiển vi khi các vật kính có khẩu độ và độ phóng đại số thấp đang được sử dụng để thu thập dữ liệu. Điều khiển thu phóng nên được sử dụng một cách thận trọng do thực tế là các hệ số thu phóng cao dẫn đến tăng tẩy trắng quang.
 Nhược điểm chính của kính hiển vi đồng tiêu quét laser thông thường để chụp ảnh tế bào và mô là hình ảnh được thu thập bằng cách quét raster mẫu vật, quá trình này tương đối chậm và thường cần vài giây hoặc lâu hơn cho mỗi hình ảnh. Ngoài ra còn có một mức độ rủi ro cao từ việc chiếu xạ mẫu vật bằng ánh sáng laze cường độ cao có thể tạo ra độc tố quang trong các tế bào sống. Trong hầu hết các trường hợp, thời gian dừng của chùm tia laze tại bất kỳ vị trí nào trên mẫu vật chỉ là vài micro giây. Do đó, năng lượng kích thích bằng laser phải đủ cao để tạo ra tín hiệu có thể sử dụng được trong thời gian dừng đó, thường dẫn đến sự bão hòa hoàn toàn của tất cả các chất huỳnh quang cư trú tại điểm. Trong những điều kiện này, quá trình tẩy trắng quang diễn ra nhanh chóng và việc thu thập hình ảnh có dải động nội cảnh cao (một số lượng đáng kể các mức xám) là một thách thức. Đối với hình ảnh tế bào sống trong thời gian dài, nên giảm cường độ laser càng nhiều càng tốt. Thách thức lớn đối với việc chụp ảnh tế bào sống bằng cách sử dụng kính hiển vi đồng tiêu quét laser là tạo ra đủ độ tương phản trong khi giảm độc tính quang, đặc biệt là trong trường hợp các tế bào được chụp ảnh trong thời gian dài.
Nhược điểm chính của kính hiển vi đồng tiêu quét laser thông thường để chụp ảnh tế bào và mô là hình ảnh được thu thập bằng cách quét raster mẫu vật, quá trình này tương đối chậm và thường cần vài giây hoặc lâu hơn cho mỗi hình ảnh. Ngoài ra còn có một mức độ rủi ro cao từ việc chiếu xạ mẫu vật bằng ánh sáng laze cường độ cao có thể tạo ra độc tố quang trong các tế bào sống. Trong hầu hết các trường hợp, thời gian dừng của chùm tia laze tại bất kỳ vị trí nào trên mẫu vật chỉ là vài micro giây. Do đó, năng lượng kích thích bằng laser phải đủ cao để tạo ra tín hiệu có thể sử dụng được trong thời gian dừng đó, thường dẫn đến sự bão hòa hoàn toàn của tất cả các chất huỳnh quang cư trú tại điểm. Trong những điều kiện này, quá trình tẩy trắng quang diễn ra nhanh chóng và việc thu thập hình ảnh có dải động nội cảnh cao (một số lượng đáng kể các mức xám) là một thách thức. Đối với hình ảnh tế bào sống trong thời gian dài, nên giảm cường độ laser càng nhiều càng tốt. Thách thức lớn đối với việc chụp ảnh tế bào sống bằng cách sử dụng kính hiển vi đồng tiêu quét laser là tạo ra đủ độ tương phản trong khi giảm độc tính quang, đặc biệt là trong trường hợp các tế bào được chụp ảnh trong thời gian dài.
Kính hiển vi đồng tiêu đĩa quay
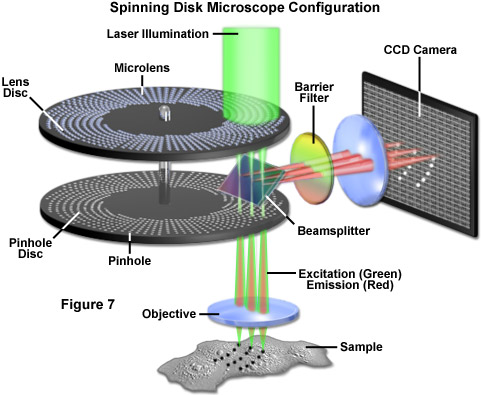
Một biến thể của kính hiển vi đồng tiêu dựa trên điện kế là kính hiển vi đồng tiêu đĩa quay, có thể hoạt động trong thời gian thực (30 khung hình mỗi giây) hoặc thậm chí nhanh hơn để nắm bắt các sự kiện động trong một dải thời gian rộng. Nguyên tắc này dựa trên một đĩa kiểu Nipkow không trong suốt, ngoại trừ hàng nghìn lỗ kim được khoan hoặc khắc, thường được phủ bằng thấu kính hội tụ thu nhỏ, được sắp xếp theo mô hình xoắn ốc Archimedean xen kẽ. Mỗi lỗ kim được chiếu sáng trên đĩa được vật kính tạo ảnh thành một điểm giới hạn nhiễu xạ trên mẫu vật. Phát xạ huỳnh quang phản xạ từ mẫu vật có thể được quan sát và ghi lại sau khi nó đi qua các lỗ kim của đĩa Nipkow. Vài nghìn điểm trên mẫu vật được chiếu sáng đồng thời bởi đĩa, trên thực tế, đạt được vài nghìn kính hiển vi đồng tiêu, tất cả đều chạy song song.
Một giải pháp thay thế cho đĩa Nipkow liên quan đến công nghệ gần đây cung cấp thông lượng ánh sáng cao bằng cách sử dụng đĩa được khắc bằng mô hình các khe vuông góc, thay vì lỗ kim, mang lại khả năng truyền dẫn lớn hơn trong khi vẫn duy trì mức độ đồng tiêu có thể chấp nhận được (Hình 7). Không giống như các đĩa kiểu Nipkow, các đĩa kiểu khe này được sản xuất với các độ rộng khe khác nhau phù hợp với các khẩu độ, độ phóng đại và độ dày mẫu vật khác nhau. Do đó, các đĩa khe cho phép thu được hình ảnh đồng tiêu ở độ phân giải cao bằng cách sử dụng các vật kính có độ phóng đại từ 10x đến 100x. Cả hai thiết kế đĩa quay đều được phát triển chủ yếu cho các ứng dụng tạo ảnh tế bào sống, nơi tồn tại sự thỏa hiệp giữa việc tăng tốc độ thu nhận ảnh cần thiết với việc giảm nhẹ độ phân giải trục (Hình 8(c)).
 Một số nhà sản xuất đã giới thiệu các hệ thống tiêu điểm sử dụng ánh sáng laze được định hình thành một đường chứ không phải là một điểm để quét mẫu vật, nhưng giảm đáng kể thời gian thu nhận hình ảnh do độ phân giải (thường là hệ số 1,2 trong một chiều). Không giống như trường hợp với kính hiển vi đĩa quay, mức độ đồng tiêu có thể được kiểm soát bởi người dùng bằng cách gọi các thay đổi đối với hình dạng và kích thước của đường. Kính hiển vi quét dòng được sử dụng với hệ thống camera CCD chứ không phải là bộ nhân quang và thường có tốc độ thu nhận nhanh hơn nhiều so với đĩa quay hoặc kính hiển vi đồng tiêu quét laze. Tóm lại, đã có một sự bùng nổ to lớn về mức độ phổ biến của kính hiển vi đồng tiêu trong những năm gần đây,
Một số nhà sản xuất đã giới thiệu các hệ thống tiêu điểm sử dụng ánh sáng laze được định hình thành một đường chứ không phải là một điểm để quét mẫu vật, nhưng giảm đáng kể thời gian thu nhận hình ảnh do độ phân giải (thường là hệ số 1,2 trong một chiều). Không giống như trường hợp với kính hiển vi đĩa quay, mức độ đồng tiêu có thể được kiểm soát bởi người dùng bằng cách gọi các thay đổi đối với hình dạng và kích thước của đường. Kính hiển vi quét dòng được sử dụng với hệ thống camera CCD chứ không phải là bộ nhân quang và thường có tốc độ thu nhận nhanh hơn nhiều so với đĩa quay hoặc kính hiển vi đồng tiêu quét laze. Tóm lại, đã có một sự bùng nổ to lớn về mức độ phổ biến của kính hiển vi đồng tiêu trong những năm gần đây,
Kính hiển vi đa điểm
Sự kích thích trong kính hiển vi đa photon là một quá trình phi tuyến tính chỉ xảy ra tại tiêu điểm của kính hiển vi giới hạn nhiễu xạ, cung cấp khả năng cắt các mẫu vật sinh học dày về mặt quang học để thu được độ phân giải ba chiều. Các phần quang học riêng lẻ có được bằng cách quét raster mẫu vật trong mặt phẳng x – y và hình ảnh ba chiều đầy đủ được tạo bằng cách quét liên tiếp mẫu vật theo trục liên tiếp (z) các vị trí, tương tự như trường hợp trong kính hiển vi đồng tiêu (để tạo ra các phần quang học). Do vị trí của tiêu điểm có thể được xác định và kiểm soát chính xác nên huỳnh quang đa photon đặc biệt hữu ích để thăm dò các vùng được chọn bên dưới bề mặt mẫu vật. Năng lượng kích thích cục bộ cao dùng để giảm thiểu quá trình quang hóa của fluorophores đối với những chất cư trú trong mặt phẳng tiêu cự và do đó làm giảm độc tính quang, làm tăng khả năng tồn tại của mẫu và thời gian tiếp theo của các thí nghiệm nghiên cứu tính chất của tế bào và mô sống. Ngoài ra, việc áp dụng các bước sóng kích thích cận hồng ngoại cho phép thâm nhập sâu hơn vào các vật liệu sinh học và giảm mức độ tán xạ ánh sáng cao được quan sát thấy ở các bước sóng ngắn hơn.
Ứng dụng kính hiển vi huỳnh quang
Kính hiển vi huỳnh quang phản xạ nội toàn phần (TIRFM) là một kỹ thuật được thiết kế để thăm dò bề mặt của các tế bào sống được đánh dấu huỳnh quang bằng sóng tắt dần được tạo ra bởi một chùm ánh sáng truyền giữa hai môi trường có chiết suất khác nhau. Trong thực tế, một chùm tia laze tới bị phản xạ ở một góc tới hạn (phản xạ toàn phần bên trong) khi nó gặp mặt phân cách giữa lớp phủ kính hiển vi và môi trường nước chứa các tế bào. Các huỳnh quang trong phạm vi khoảng 10 giây của bề mặt nanomet (từ 10 đến 200 nanomet) bị kích thích bởi sóng biến thiên, trong khi những tế bào ở xa hơn hầu như không bị ảnh hưởng, vì năng lượng của sóng biến thiên giảm theo cấp số nhân với khoảng cách từ lớp phủ. Do đó, TIRFM dẫn đến mức tín hiệu cao phát sinh từ các chất huỳnh quang cư trú gần lớp phủ, được đặt chồng lên trên một nền rất tối, cung cấp tỷ lệ tín hiệu trên tạp âm tốt nhất có thể. Giới hạn cực độ về độ sâu kích thích là lý tưởng để nghiên cứu các phân tử đơn lẻ hoặc các thành phần màng và cơ quan gần bề mặt của lớp phủ trong các tế bào kết dính (xem Hình 8(e)). Vì sự kích thích được giới hạn ở vùng mỏng tiếp giáp với lớp phủ, quá trình tẩy trắng và độc tính quang cũng bị giới hạn ở những khu vực này, khiến TIRFM trở thành một trong những phương pháp hữu ích nhất cho các quan sát dài hạn. Kỹ thuật này đã trở thành một công cụ cơ bản để điều tra một loạt các hiện tượng trong tế bào và sinh học phân tử. Vì sự kích thích được giới hạn ở vùng mỏng tiếp giáp với lớp phủ, quá trình tẩy trắng và độc tính quang cũng bị giới hạn ở những khu vực này, khiến TIRFM trở thành một trong những phương pháp hữu ích nhất cho các quan sát dài hạn. Kỹ thuật này đã trở thành một công cụ cơ bản để điều tra một loạt các hiện tượng trong tế bào và sinh học phân tử. Vì sự kích thích được giới hạn ở vùng mỏng tiếp giáp với lớp phủ, quá trình tẩy trắng và độc tính quang cũng bị giới hạn ở những khu vực này, khiến TIRFM trở thành một trong những phương pháp hữu ích nhất cho các quan sát dài hạn. Kỹ thuật này đã trở thành một công cụ cơ bản để điều tra một loạt các hiện tượng trong tế bào và sinh học phân tử.
Phân tích giải chập là một kỹ thuật áp dụng các thuật toán cho một chồng hình ảnh lấy nét xuyên suốt thu được dọc theo quang học ( z) để tăng cường tín hiệu photon cụ thể cho một mặt phẳng hình ảnh nhất định hoặc nhiều mặt phẳng tiêu cự trong chồng hình ảnh. Kính hiển vi phải được trang bị một ổ lấy nét cơ giới có độ chính xác cao để đảm bảo thu được hình ảnh ở các khoảng được xác định chính xác giữa các mặt phẳng tiêu cự trong mẫu vật. Trong một ứng dụng điển hình (xem Hình 8(f)), phân tích giải chập được sử dụng để làm mờ và loại bỏ ánh sáng nằm ngoài vùng lấy nét khỏi một mặt phẳng tiêu điểm quan tâm cụ thể bằng cách sử dụng kích thích và phát xạ huỳnh quang trường rộng (mặc dù kỹ thuật này hữu ích cho các chế độ chiếu sáng khác cũng). Các ứng dụng phức tạp nhất áp dụng phân tích giải chập cho toàn bộ ngăn xếp hình ảnh để tạo ra các hình chiếu hoặc mô hình ba chiều. Tập hợp các hình ảnh trường rộng được sử dụng để phân tích giải chập sẽ ghi lại số lượng photon tối đa theo lý thuyết mà mẫu vật phát ra. Quá trình giải chập chỉ định lại cường độ “mờ” phát sinh từ các photon phát ra bên trên và bên dưới mặt phẳng tiêu điểm cho mặt phẳng gốc. Do đó, giải chập sử dụng thực tế tất cả cường độ phát xạ có sẵn và cung cấp ngân sách ánh sáng tốt nhất có thể, do đó làm cho kỹ thuật này trở thành phương pháp được lựa chọn cho các mẫu cực kỳ nhạy sáng.
 Sự thích ứng của hiện tượng truyền năng lượng cộng hưởng sang kính hiển vi huỳnh quang, huỳnh quang hoặc truyền năng lượng cộng hưởng Forster (FRET) được sử dụng để thu được thông tin định lượng về thời gian và không gian về sự liên kết và tương tác của protein, lipid, enzyme và axit nucleic trong tế bào sống. Kính hiển vi FRET được thực hiện bằng cách sử dụng trạng thái ổn định hoặc kỹ thuật giải quyết thời gian, nhưng hình ảnh FRET được giải quyết theo thời gian có lợi thế là ánh xạ chính xác hơn khoảng cách người cho-người nhận. Một kính hiển vi huỳnh quang trường rộng tiêu chuẩn được trang bị các bộ lọc kích thích và phát xạ thích hợp và một máy quay video nhạy cảm có thể được sử dụng để thực hiện hình ảnh FRET. Các cảm biến sinh học kẹp một protein hoặc peptide nhạy cảm với môi trường giữa hai protein phát huỳnh quang có khả năng FRET hiện đang được sử dụng rộng rãi trong sinh học tế bào. Những đầu dò này dễ dàng được chụp ảnh trong kính hiển vi huỳnh quang trường rộng bằng cách sử dụng các kỹ thuật FRET phát xạ nhạy cảm kết hợp với phân tích đo lường.
Sự thích ứng của hiện tượng truyền năng lượng cộng hưởng sang kính hiển vi huỳnh quang, huỳnh quang hoặc truyền năng lượng cộng hưởng Forster (FRET) được sử dụng để thu được thông tin định lượng về thời gian và không gian về sự liên kết và tương tác của protein, lipid, enzyme và axit nucleic trong tế bào sống. Kính hiển vi FRET được thực hiện bằng cách sử dụng trạng thái ổn định hoặc kỹ thuật giải quyết thời gian, nhưng hình ảnh FRET được giải quyết theo thời gian có lợi thế là ánh xạ chính xác hơn khoảng cách người cho-người nhận. Một kính hiển vi huỳnh quang trường rộng tiêu chuẩn được trang bị các bộ lọc kích thích và phát xạ thích hợp và một máy quay video nhạy cảm có thể được sử dụng để thực hiện hình ảnh FRET. Các cảm biến sinh học kẹp một protein hoặc peptide nhạy cảm với môi trường giữa hai protein phát huỳnh quang có khả năng FRET hiện đang được sử dụng rộng rãi trong sinh học tế bào. Những đầu dò này dễ dàng được chụp ảnh trong kính hiển vi huỳnh quang trường rộng bằng cách sử dụng các kỹ thuật FRET phát xạ nhạy cảm kết hợp với phân tích đo lường.
Kính hiển vi hình ảnh thời gian tồn tại huỳnh quang (FLIM) là một kỹ thuật phức tạp cho phép ghi lại đồng thời cả thời gian tồn tại của huỳnh quang và vị trí không gian của các chất huỳnh quang trên mọi vị trí trong ảnh. Phương pháp này cung cấp một cơ chế để nghiên cứu các thông số môi trường như pH, nồng độ ion, độ phân cực của dung môi, tương tác không cộng hóa trị, độ nhớt và sức căng oxy trong các tế bào sống đơn lẻ, trình bày dữ liệu theo mảng không gian và thời gian. Các phép đo FLIM về thời gian tồn tại ở trạng thái kích thích nano giây không phụ thuộc vào nồng độ fluorophore cục bộ, tạo tác tẩy trắng bằng quang hóa và độ dài đường dẫn (độ dày mẫu vật), nhưng nhạy cảm với các phản ứng ở trạng thái kích thích như truyền năng lượng cộng hưởng. Trong thực tế,
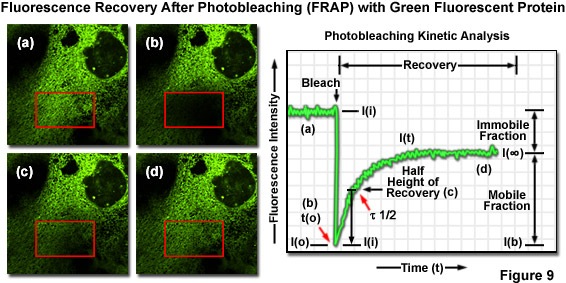
Độ linh động tịnh tiến (hệ số khuếch tán bên) của các đại phân tử được đánh dấu huỳnh quang và các chất phát huỳnh quang nhỏ có thể được xác định bằng khả năng phục hồi huỳnh quang sau khi tẩy trắng quang học(FRAP) kỹ thuật. Trong FRAP, một vùng rất nhỏ, được chọn (đường kính vài micromet) được chiếu sáng cường độ cao, thường là bằng tia laser, để tạo ra quá trình quang hóa hoàn toàn các fluorophores trong vùng. Kết quả là làm giảm đáng kể hoặc triệt tiêu huỳnh quang. Sau xung tẩy trắng bằng quang hóa, tốc độ và mức độ phục hồi cường độ huỳnh quang ở vùng được tẩy trắng được theo dõi như một hàm của thời gian ở cường độ kích thích thấp hơn để tạo ra thông tin về quá trình tái tạo dân số bằng fluorophores và động học của quá trình phục hồi (Hình 9). FRAP thường được tiến hành bằng cách sử dụng EGFP hoặc các protein huỳnh quang khác. Các kỹ thuật kích hoạt quang liên quan dựa trên các chất huỳnh quang tổng hợp được lồng trong lồng chuyên dụng hoặc các protein huỳnh quang được ưu đãi tương tự có thể được kích hoạt bằng một xung ngắn của tia cực tím hoặc ánh sáng tím.
 Trong một kỹ thuật liên quan đến FRAP (không thể phát quang trong quá trình tẩy trắng bằng ánh sáng ; FLIP ), một vùng huỳnh quang xác định trong một tế bào sống phải chịu quá trình tẩy trắng lặp đi lặp lại bằng cách chiếu sáng bằng bức xạ cường độ cao. Trong một khoảng thời gian đo được, hành động này sẽ dẫn đến mất hoàn toàn tín hiệu huỳnh quang trong toàn bộ tế bào nếu tất cả các chất phát huỳnh quang có thể khuếch tán vào vùng đang được tẩy trắng quang hóa. Bằng cách tính toán tốc độ mà huỳnh quang bị dập tắt khỏi toàn bộ tế bào, có thể xác định được độ linh động khuếch tán của chất huỳnh quang mục tiêu. Hơn nữa, FLIP sẽ dễ dàng xác định vị trí và bản chất của bất kỳ rào cản khuếch tán nào giữa các ngăn riêng lẻ của tế bào, chẳng hạn như rào cản giữa soma và sợi trục của nơ-ron.
Trong một kỹ thuật liên quan đến FRAP (không thể phát quang trong quá trình tẩy trắng bằng ánh sáng ; FLIP ), một vùng huỳnh quang xác định trong một tế bào sống phải chịu quá trình tẩy trắng lặp đi lặp lại bằng cách chiếu sáng bằng bức xạ cường độ cao. Trong một khoảng thời gian đo được, hành động này sẽ dẫn đến mất hoàn toàn tín hiệu huỳnh quang trong toàn bộ tế bào nếu tất cả các chất phát huỳnh quang có thể khuếch tán vào vùng đang được tẩy trắng quang hóa. Bằng cách tính toán tốc độ mà huỳnh quang bị dập tắt khỏi toàn bộ tế bào, có thể xác định được độ linh động khuếch tán của chất huỳnh quang mục tiêu. Hơn nữa, FLIP sẽ dễ dàng xác định vị trí và bản chất của bất kỳ rào cản khuếch tán nào giữa các ngăn riêng lẻ của tế bào, chẳng hạn như rào cản giữa soma và sợi trục của nơ-ron.
Việc sử dụng ngày càng nhiều protein huỳnh quang với phổ phát xạ chồng chéo cao trong hình ảnh tế bào sống thường đòi hỏi các giải pháp độc đáo để cung cấp sự phân tách đầy đủ các tín hiệu từ các mục tiêu khác nhau. Hình ảnh quang phổ dựa trên phần cứng chuyên dụng (chủ yếu được kết hợp với kính hiển vi đồng tiêu) để tách ánh sáng phát xạ thành các thành phần quang phổ của nó. Unmixing tuyến tính là một quy trình tính toán liên quan đến giải chập sử dụng cấu hình quang phổ duy nhất của từng chất huỳnh quang trong mẫu vật để gán lại tín hiệu cho các pixel thích hợp trong hình ảnh cuối cùng. Mặc dù các công cụ phân tích này có thể được sử dụng cùng nhau để phân biệt giữa các chất phát quang riêng biệt có phổ chồng lấp cao, nhưng chúng hoạt động với cái giá phải trả là yêu cầu phát hiện nhiều photon hơn đáng kể từ mỗi pixel, điều này có thể gây khó khăn cho việc chụp ảnh tế bào sống của mẫu vật được dán nhãn chất phát quang mờ hoặc các mục tiêu phong phú thấp.
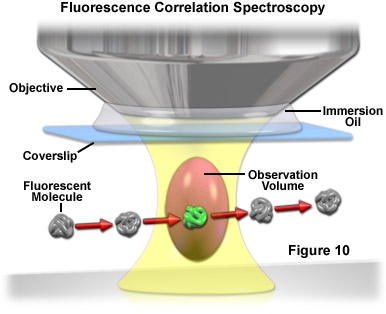
Được sử dụng chủ yếu với kính hiển vi quét đồng tiêu hoặc đa điểm quét laser, phổ tương quan huỳnh quang (FCS) là một kỹ thuật được thiết kế để xác định động lực học phân tử trong các thể tích chỉ chứa một hoặc một vài phân tử, mang lại thông tin về tốc độ phản ứng hóa học, hệ số khuếch tán, trọng lượng phân tử, tốc độ dòng chảy và sự kết tụ. Trong FCS, một thể tích nhỏ (xấp xỉ một femtolit; tiêu điểm giới hạn nhiễu xạ của chùm tia laze) được chiếu xạ bằng chùm tia laze hội tụ để ghi lại các dao động cường độ huỳnh quang tự phát phát sinh từ động lực học của các phân tử huỳnh quang chiếm thể tích như một hàm của thời gian ( xem Hình 10). Các huỳnh quang tương đối nhỏ khuếch tán nhanh chóng qua thể tích được chiếu sáng để tạo ra các đợt cường độ ngắn, ngẫu nhiên. Ngược lại, các phức hợp lớn hơn (các chất huỳnh quang liên kết với các đại phân tử) di chuyển chậm hơn và tạo ra kiểu cường độ huỳnh quang phụ thuộc vào thời gian lâu hơn, bền vững hơn.
Động lực vốn có và sự phân bố không gian của các cấu trúc được dán nhãn huỳnh quang có thể khó phân tích khi các thực thể này được đóng gói dày đặc và chồng chéo trong các vùng cụ thể của tế bào sống. Kính hiển vi đốm huỳnh quang (FSM) là một kỹ thuật tương thích với hầu hết tất cả các phương thức hình ảnh tận dụng nồng độ rất thấp của các tiểu đơn vị được đánh dấu huỳnh quang để giảm hiện tượng huỳnh quang ngoài tiêu điểm và cải thiện khả năng hiển thị của các cấu trúc được đánh dấu và động lực học của chúng trong các vùng dày. FSM được thực hiện bằng cách chỉ dán nhãn một phần của toàn bộ cấu trúc quan tâm. Theo nghĩa đó, nó tương tự như việc thực hiện FCS trên toàn bộ trường nhìn, mặc dù nhấn mạnh hơn vào các mẫu không gian hơn là phân tích thời gian định lượng. Kính hiển vi đốm (như nó thường được gọi) đặc biệt hữu ích trong việc xác định tính di động và trùng hợp của các yếu tố khung tế bào, chẳng hạn như actin và vi ống, trong các tế bào có tính di động cao.
Lợi ích chính của kính hiển vi tán xạ Raman chống Stokes kết hợp (CARS) là nó cho phép nghiên cứu các phân tử sinh học mà không cần bổ sung nhãn huỳnh quang tổng hợp hoặc liên kết nội sinh với protein huỳnh quang. Thay vào đó, kỹ thuật này dựa trên các đặc tính rung động của phân tử mục tiêu và không yêu cầu loài này bị kích thích điện tử bởi tia cực tím hoặc ánh sáng khả kiến. Trong thực tế, các xung laze nhanh (pico giây hoặc thấp hơn) trong vùng cận hồng ngoại từ hai nguồn được hội tụ vào mẫu vật bằng vật kính hiển vi và được quét raster trong các mặt phẳng bên và trục. Các xung được phân tách theo tần số bằng một chế độ dao động phân tử đã chọn và tạo ra một chùm tia mới, có bước sóng ngắn hơn các chùm tia tới, tại tiêu điểm vật kính. Chùm thứ cấp tạo ra một hồ sơ nồng độ của các loài mục tiêu và cho phép xây dựng hình ảnh ba chiều của mẫu vật. Bởi vì hầu hết các phân tử sinh học được tìm thấy trong các tế bào sống đều có các khối xây dựng giống nhau nên rất khó để đạt được tính đặc hiệu phân tử thực sự trong các thí nghiệm CARS. Hơn nữa, CARS dựa trên sự cộng hưởng, nghĩa là độ nhạy của nó bị hạn chế bởi thực tế là phải có hàng nghìn phân tử trong âm lượng tiêu điểm để tạo ra mức tín hiệu đáng kể. Do đó, CARS (ở dạng hiện tại) phải nhắm mục tiêu vào các phân tử phong phú và có thể bị hạn chế dựa vào việc ghi nhãn bên ngoài (chẳng hạn như sử dụng các hợp chất khử màu) để cung cấp tính đặc hiệu phân tử thực sự. rất khó để đạt được tính đặc hiệu phân tử thực sự trong các thí nghiệm CARS. Hơn nữa, CARS dựa trên sự cộng hưởng, nghĩa là độ nhạy của nó bị hạn chế bởi thực tế là phải có hàng nghìn phân tử trong âm lượng tiêu điểm để tạo ra mức tín hiệu đáng kể. Do đó, CARS (ở dạng hiện tại) phải nhắm mục tiêu vào các phân tử phong phú và có thể bị hạn chế dựa vào việc ghi nhãn bên ngoài (chẳng hạn như sử dụng các hợp chất khử màu) để cung cấp tính đặc hiệu phân tử thực sự. rất khó để đạt được tính đặc hiệu phân tử thực sự trong các thí nghiệm CARS. Hơn nữa, CARS dựa trên sự cộng hưởng, nghĩa là độ nhạy của nó bị hạn chế bởi thực tế là phải có hàng nghìn phân tử trong âm lượng tiêu điểm để tạo ra mức tín hiệu đáng kể. Do đó, CARS (ở dạng hiện tại) phải nhắm mục tiêu vào các phân tử phong phú và có thể bị hạn chế dựa vào việc ghi nhãn bên ngoài (chẳng hạn như sử dụng các hợp chất khử màu) để cung cấp tính đặc hiệu phân tử thực sự.
 Kính hiển vi tạo sóng hài là một kỹ thuật mới nổi mà cuối cùng có thể được sử dụng rộng rãi trong hình ảnh tế bào sống. Sự tạo ra sóng hài xảy ra khi một sự kiện kích thích quang học liên quan đến hai hoặc nhiều photon ở một tần số cụ thể dẫn đến sự phát xạ hợp tác ở nhiều sóng hài (chủ yếu là sóng hài thứ hai và thứ ba) mà không có sự hấp thụ của các photon. Việc tạo ra các tần số sóng hài về cơ bản là một quá trình tán xạ phi tuyến tính tạo ra bước sóng photon phát ra gấp đôi tần số hoặc một nửa bước sóng (đối với sự tạo sóng hài thứ hai) của ánh sáng tới. Trong kính hiển vi quang học, các mẫu vật trong suốt thiếu tính đối xứng (chẳng hạn như tế bào sống) là ứng cử viên lý tưởng để chụp ảnh bằng các kỹ thuật tạo sóng hài. Không giống như tình huống với các đầu dò điển hình và kỹ thuật chiếu sáng bằng kính hiển vi huỳnh quang truyền thống, thay đổi bước sóng chiếu sáng kích thích tạo ra sự thay đổi tương ứng trong bước sóng phát xạ. Ngoài ra, ánh sáng phát ra là nhất quán và giữ lại thông tin pha về mẫu vật.
Kính hiển vi tạo sóng hài là một kỹ thuật mới nổi mà cuối cùng có thể được sử dụng rộng rãi trong hình ảnh tế bào sống. Sự tạo ra sóng hài xảy ra khi một sự kiện kích thích quang học liên quan đến hai hoặc nhiều photon ở một tần số cụ thể dẫn đến sự phát xạ hợp tác ở nhiều sóng hài (chủ yếu là sóng hài thứ hai và thứ ba) mà không có sự hấp thụ của các photon. Việc tạo ra các tần số sóng hài về cơ bản là một quá trình tán xạ phi tuyến tính tạo ra bước sóng photon phát ra gấp đôi tần số hoặc một nửa bước sóng (đối với sự tạo sóng hài thứ hai) của ánh sáng tới. Trong kính hiển vi quang học, các mẫu vật trong suốt thiếu tính đối xứng (chẳng hạn như tế bào sống) là ứng cử viên lý tưởng để chụp ảnh bằng các kỹ thuật tạo sóng hài. Không giống như tình huống với các đầu dò điển hình và kỹ thuật chiếu sáng bằng kính hiển vi huỳnh quang truyền thống, thay đổi bước sóng chiếu sáng kích thích tạo ra sự thay đổi tương ứng trong bước sóng phát xạ. Ngoài ra, ánh sáng phát ra là nhất quán và giữ lại thông tin pha về mẫu vật.
Để có độ phân giải quang học cực cao, kính hiển vi quang học quét trường gần(NSOM) hiện là kỹ thuật quang tử được lựa chọn. Hình ảnh trường gần xảy ra khi một đầu dò quang học có kích thước micron phụ được đặt cách mẫu một khoảng rất ngắn và ánh sáng được truyền qua một lỗ nhỏ ở đầu của đầu dò này. Trường gần được định nghĩa là vùng phía trên một bề mặt có kích thước nhỏ hơn một bước sóng ánh sáng tới trên bề mặt đó. Trong vùng trường gần, ánh sáng bay hơi không bị giới hạn nhiễu xạ và có thể phân giải không gian nanomet. Hiện tượng này cho phép chụp ảnh và quang phổ giới hạn không nhiễu xạ của một mẫu mà phương pháp chụp ảnh quang học thông thường không thể thực hiện được. Mặc dù hiện nay hiếm khi được áp dụng cho hình ảnh tế bào sống, các kỹ thuật liên quan như kính hiển vi lực nguyên tử đang được khám phá để kiểm tra bề mặt của các tế bào sống.
Hiển thị độ phân giải không gian vượt xa giới hạn nhiễu xạ, kính hiển vi suy giảm phát xạ kích thích ( STED) là một kỹ thuật siêu phân giải mới nổi sử dụng chùm suy giảm hình bánh rán bao quanh chùm kích thích nhỏ hơn để đạt được độ phân giải trục thấp hơn 50 nanomet. Kỹ thuật này dựa vào việc ức chế sự phát huỳnh quang của các phân tử bị kích thích ở ngoại vi của tiêu điểm quét laze bằng cách sử dụng các xung laze được đồng bộ hóa để kích thích các chất huỳnh quang và các xung STED tròn được phối hợp không gian để làm giảm phát xạ. Kết quả là huỳnh quang bị ức chế ở ngoại vi của vết, nhưng không phải ở trung tâm, do đó làm giảm đáng kể kích thước vết huỳnh quang cùng với sự gia tăng độ phân giải. STED đã được chứng minh là một công cụ hữu ích để kiểm tra các tế bào sống ở độ phân giải cao. Các kỹ thuật siêu phân giải mới nổi khác, chẳng hạn như kính hiển vi định vị quang hóa (PALM) và kính hiển vi chiếu sáng có cấu trúc ( SIM ) có thể sẽ trở thành công cụ thiết yếu trong chụp ảnh tế bào sống trong tương lai gần.
Kết luận
Việc sử dụng ngày càng nhiều các protein huỳnh quang được mã hóa di truyền và các fluorophores tổng hợp tiên tiến để chụp ảnh tế bào sống đã mở cơ hội cho các phương thức quang học hữu ích. Nhà kính hiển vi hiện có đầy đủ các công cụ để xem và ghi lại dữ liệu hình ảnh của các quá trình xảy ra trong một khoảng thời gian dài và ở nhiều độ phân giải. Các sự kiện dễ dàng được quan sát và ghi lại bằng kính hiển vi đồng tiêu quét laze, trong khi có thể truy cập nhanh hơn thông qua việc sử dụng các kỹ thuật đĩa quay. Ngoài ra, kính hiển vi đa điểm cho phép chụp ảnh sâu bên trong các mô dày và kỹ thuật phản xạ toàn phần bên trong có thể thăm dò bề mặt màng với độ chính xác đồng tiêu. Phương pháp huỳnh quang tiên tiến, chẳng hạn như FRET, FLIM, FRAP, FCS, FSM, SIM, PALM và STED, có thể được sử dụng để theo dõi các tương tác protein-protein, thường ở độ phân giải lớn hơn độ phân giải cho phép.
Nguồn: https://zeiss-campus.magnet.fsu.edu/articles/livecellimaging/techniques.html
Công ty Minh Khang là nhà phân phối độc quyền thị trường miền Nam phân khúc kính hiển vi hãng Carl ZEISS.


 EN
EN