Xét nghiệm sinh thiết lỏng (liquid biopsy) cung cấp phương pháp không xâm lấn hoặc ít xâm lấn để đánh giá các quá trình sinh lý hoặc bệnh lý mà trong trường hợp khác cần phải tiến hành cắt mô hoặc các thủ thuật xâm lấn khác. Hầu hết các cách chẩn đoán ung thư hiện nay đều yêu cầu việc lấy mẫu dịch, hoặc là việc lấy mẫu cắt mô tối đa. Trong trường hợp này, sinh thiết lỏng có thể thay thế lấy mẫu dịch, nội soi hay phẫu thuật bằng việc phân tích mẫu máu để phát hiện tế bào ung thư lưu hành hoặc axit nucleic tuần hoàn tự do. Vì các thủ thuật chẩn đoán xâm lấn liên quan đến rủi ro về chảy máu, chảy máu nội tiết, tổn thương mô, tạo điều kiện cho tế bào ung thư lây lan vào các mô xung quanh, xét nghiệm sinh thiết lỏng là một phương pháp an toàn hơn.
Bác sĩ hiện đang sử dụng quét CT, MRI hoặc PET lặp lại để đánh giá phản ứng điều trị và tiến triển bệnh. Các nghiên cứu hình ảnh này tốn kém, tốn thời gian và làm cho bệnh nhân tiếp xúc với tia phóng xạ bên ngoài, chất tương phản truyền vào tĩnh mạch và/hoặc chất vết cơ học. Hơn nữa, các nghiên cứu hình ảnh không cung cấp bất kỳ thông tin nào về kiểu mẫu u, mà có thể thay đổi theo liệu pháp. Hiện nay, thông tin kiểu mẫu u thường được thu thập thông qua việc lấy mẫu cắt mô. Tuy nhiên, việc thực hiện lấy mẫu cắt mô lặp lại hiếm khi khả thi do chi phí và rủi ro đối với bệnh nhân. Ngược lại, sinh thiết lỏng có thể cung cấp một đánh giá về ung thư với chi phí tương đối thấp. Bệnh nhân sẽ không phải chịu rủi ro nhiều hơn so với việc lấy mẫu máu đơn giản. Hơn nữa, các phương pháp sinh thiết lỏng có thể phát hiện lại sự tái phát của ung thư trước khi khối u trở nên rõ ràng trên hình ảnh hoặc đủ lớn cho việc lấy mẫu cắt mô truyền thống.
Mặc dù sinh thiết lỏng có nhiều ưu điểm nhưng lĩnh vực này vẫn còn mới và đang tiến triển nhanh chóng. Một số ứng dụng sinh thiết lỏng đã có sẵn, với nhiều ứng dụng; tuy nhiên, một số ứng dụng tiềm năng vẫn chưa được tiến hành. Bài viết dưới đây sẽ thảo luận về tình trạng hiện tại của sinh thiết lỏng, với sự tập trung đặc biệt vào di truyền học ung thư. Bài viết cũng sẽ thảo luận về một số yếu tố quan trọng để tiến hành thành công với DNA không gắn liền với tế bào (cfDNA), và sẽ kết thúc với hướng phát triển tương lai của lĩnh vực này.
Các ứng dụng sinh thiết lỏng
Các xét nghiệm sàng lọc thai kỳ, y học cấy ghép và ung thư đang thúc đẩy khoa học về xét nghiệm sinh thiết lỏng, và đã tạo ra một số ứng dụng lâm sàng rõ ràng.
Sàng lọc thai kỳ
Ứng dụng lâm sàng có phạm vi rõ ràng nhất cho xét nghiệm sinh thiết lỏng là trong sàng lọc thai kỳ. Có những lợi ích rõ ràng khi có thể kiểm tra mô tử cung cho các bất thường di truyền/ nhiễm sắc thể trong giai đoạn sớm của thai kỳ; tuy nhiên, việc lấy mẫu mô bằng cách sử dụng phương pháp lấy mẫu nang lông tử cung hoặc chọc tế bào nước tiểu liên quan đến nguy cơ tử vong hoặc tử vong của thai nhi. Ngược lại, xét nghiệm sinh thiết lỏng mang lại khả năng xét nghiệm tiền sản dựa trên mẫu máu của mẹ.
Những thành công đầu tiên của xét nghiệm sinh thiết lỏng trong xét nghiệm tiền sản là các xét nghiệm tế bào tử cung toàn bộ cho trisomy 21, 18 và 13. Các tế bào tử cung đã đi vào tuần hoàn máu của mẹ có thể được thu thập cho xét nghiệm sinh thiết lỏng và được kiểu hình để xác định các bất thường nhiễm sắc thể. Gần đây hơn, xét nghiệm cfDNA đã được sử dụng để phát hiện các trisomy đã nêu trên, và cũng để xác định nhóm máu ABO, dị hình nhiễm sắc thể của nhiễm sắc thể giới tính, đột biến xóa nhiễm sắc thể và các rối loạn đột biến gen đơn lẻ.
Cấy ghép y học
Một ứng dụng chính khác của xét nghiệm sinh thiết lỏng là trong y học cấy ghép. Thường cần phải đánh giá hoạt động của cơ quan hoặc mô sau cấy ghép. Lý tưởng nhất là tránh lấy mẫu trực tiếp từ mô cấy ghép – mặc dù mẫu sinh thiết mô đôi khi là cần thiết – xét nghiệm sinh thiết lỏng có thể được sử dụng như một phương thức thay thế sẽ có lợi.
Một trong những yếu tố quan trọng trong theo dõi sau cấy ghép là đảm bảo sự ức chế miễn dịch đủ nhưng không quá mức. Giả định là ức chế hệ thống miễn dịch của người nhận cơ quan chỉ đến mức cấy ghép không bị từ chối. Sự ức chế miễn dịch tối thiểu cho phép bệnh nhân chống lại nhiễm trùng, phát hiện và quản lý các tế bào ung thư mới nảy sinh, vv.
Với mục tiêu này, xét nghiệm sinh thiết lỏng tiềm năng cho phép giám sát việc từ chối mô cấy ghép. Ví dụ, các nhà nghiên cứu đã thu thập mẫu huyết thanh và nước tiểu từ 100 bệnh nhân nhận ghép thận trong ba tháng đầu sau ca phẫu thuật cấy ghép. Tổng cfDNA tăng đáng kể trong giai đoạn từ chối cấy ghép cấp tính, và sự tăng này thường đi trước chẩn đoán lâm sàng. Ngược lại, tổng cfDNA trở lại mức cơ bản sau khi ức chế miễn dịch dừng lại. Thực sự, DNA tổng hợp và cụ thể cho cấy ghép trong nước tiểu hoặc huyết thanh có thể được sử dụng thành công để tối ưu hóa liệu pháp ức chế miễn dịch và có thể trì hoãn việc xét nghiệm sinh thiết thận.
Ung thư
Chúng ta đã biết từ những năm 1970 rằng bệnh nhân mắc ung thư có mức độ cao hơn của cfDNA/các axit nucleic tuần hoàn bình thường so với những người khỏe mạnh. Ngay từ thời điểm đó, các nhà nghiên cứu đã chỉ ra rằng mức độ DNA trong máu giảm sau khi điều trị hóa trị. Từ góc độ lý thuyết, lĩnh vực ung thư có tiềm năng ứng dụng nhiều nhất cho xét nghiệm sinh thiết lỏng. Có thể thấy được vai trò của việc sớm phát hiện và sàng lọc ung thư, chẩn đoán, theo dõi điều trị và giám sát sau điều trị. Mặc dù chúng ta sẽ thảo luận về các vai trò tiềm năng của xét nghiệm sinh thiết lỏng và tất cả các khía cạnh của ung thư này, nhưng không phải tất cả các ứng dụng này đều đã phát triển một cách đồng đều. Thực tế, ứng dụng phát triển nhiều nhất của xét nghiệm sinh thiết lỏng trong lĩnh vực ung thư là trong việc lựa chọn và theo dõi điều trị. Hầu hết các phương pháp điều trị bằng miễn dịch hoặc các phương pháp điều trị có mục tiêu cho ung thư không được áp dụng cho tất cả bệnh nhân mắc một loại ung thư nhất định. Ví dụ, một số bệnh nhân mắc ung thư phổi không tế bào nhỏ không phải ung thư biểu mô (NSCLC) sẽ được đủ điều kiện để nhận điều trị lần đầu bằng gefitinib, một chất ức chế tyrosine kinase EGFR uống; những người khác không. Điều này là do gefitinib hiệu quả hơn đáng kể đối với bệnh nhân mắc ung thư có một số đột biến cụ thể trong EGFR. Do đó, FDA đã chấp nhận gefitinib là phương pháp điều trị lần đầu cho bệnh nhân mắc NSCLC di căn này chỉ khi các bệnh nhân có đột biến cụ thể này. Cùng lúc đó, FDA cũng chấp nhận một công cụ chẩn đoán đồng hành, bộ kit PCR Therascreen EGFR RGQ, để xác định bệnh nhân có đột biến cần thiết.
Hướng phát triển của xét nghiệm sinh thiết lỏng chẩn đoán ung thư
Trong khi sinh thiết lỏng chẩn đoán ung thư đã phát triển nhất trong lĩnh vực mô tả đặc điểm khối u và lựa chọn phương pháp điều trị, các ứng dụng khác của sinh thiết lỏng cho bệnh ung thư đang dần được quan tâm.
Theo dõi điều trị
Các khối u ban đầu nhạy với các chất ức chế tyrosine kinase cụ thể như gefitinib, erlotinib, crizotinib và ceritinib thường biến đổi và phát triển kháng lại các loại thuốc này. Giống như xét nghiệm sinh thiết lỏng đã thay thế xét nghiệm mô cho sự đặc điểm ban đầu của khối u, đã có một chuyển động để sử dụng xét nghiệm sinh thiết lỏng cũng như cho việc kiểm tra sự kháng lại. Xét nghiệm sinh thiết lỏng cung cấp một công cụ không xâm lấn để phát hiện sự thay đổi trong tình trạng khối u.
Các lợi ích tiềm năng của việc đặc điểm khối u bằng xét nghiệm sinh thiết lỏng không giới hạn chỉ trong ứng dụng các chất ức chế phân tử nhỏ. Các phương pháp miễn dịch như kháng thể chặn receptor kiểm soát kiểm tra mô cytoxic tế bào liên quan 4 (CTLA-4) và tế bào tử tự lập chương trình tử tự (PD-1) có sẵn cho các bệnh nhân có một số mô khối u cụ thể. Các phương pháp xét nghiệm sinh thiết lỏng có thể được áp dụng theo cùng một cách để chọn lựa và theo dõi điều trị ung thư miễn dịch.
Sàng lọc và phát hiện ung thư sớm
Một trong những nguyên lý cơ bản của việc chăm sóc ung thư là phát hiện sớm ung thư dẫn đến kết quả tốt hơn. Thực tế, những người mắc ung thư ở giai đoạn sớm có tỷ lệ hồi phục và tỷ lệ sống sót cao hơn so với những người mắc ung thư ở giai đoạn muộn hoặc ung thư ác tính, bất kể loại ung thư nào. Tuy nhiên, việc thực hiện kiểm tra chẩn đoán tia X theo dõi hoặc các thủ tục xâm lấn để theo dõi ung thư có thể không thực tế. Xét nghiệm sinh thiết lỏng có thể kiểm tra ung thư định kỳ thông qua việc lấy máu thường xuyên hoặc kiểm tra nước tiểu.
Các ứng dụng xét nghiệm tập trung vào những thay đổi di truyền tiền ung thư sớm nhất giúp phân biệt ung thư với mô khỏe mạnh. Để có hiệu quả, bất kỳ sàng lọc nào cũng phải có độ đặc hiệu rất cao. Thật không may, một số đột biến liên quan đến ung thư đã biết có xu hướng xảy ra theo tuổi tác ngay cả ở những người không bao giờ phát triển ung thư. Vì vậy, điểm mấu chốt cho sự tiến triển của sinh thiết lỏng trong phát hiện ung thư sớm là xác định các dấu hiệu lưu hành có tính đặc hiệu cao. Mặc dù có khoảng chục xét nghiệm sàng lọc di truyền có sẵn để phát hiện sớm ung thư ở những người khỏe mạnh, nhưng xét nghiệm này ít được ứng dụng rộng rãi. Tuy nhiên, sự quan tâm nghiên cứu trong lĩnh vực này là rất lớn.
Theo dõi bệnh sau điều trị
Tế bào bệnh còn sót lại là sự tồn tại của các tế bào ung thư trong cơ thể mặc dù đã điều trị. Các tế bào này ở dưới mức độ phân giải và phát hiện của các nghiên cứu hình ảnh và được coi là một nguyên nhân chính của bệnh ung thư và tái phát. Xét nghiệm sinh thiết lỏng cho trường hợp này đã phát triển tương đối tốt trong bệnh bạch cầu, cho phép các bác sĩ phát hiện tế bào bệnh còn sót lại ở mức độ thấp hơn. Mặc dù cơ sở là giống nhau cho các khối u rắn, tiến triển trong lĩnh vực này ít phát triển hơn. Như với việc sàng lọc ung thư và phát hiện ung thư sớm, ứng dụng lâm sàng của xét nghiệm sinh thiết lỏng bị hạn chế bởi độ nhạy và độ chính xác của các xét nghiệm hiện tại. Những hạn chế này hiện đang được phát triển hơn cho việc phát hiện tế bào bệnh cho các khối u rắn so với ung thư máu.
Các loại dấu ấn ung thư
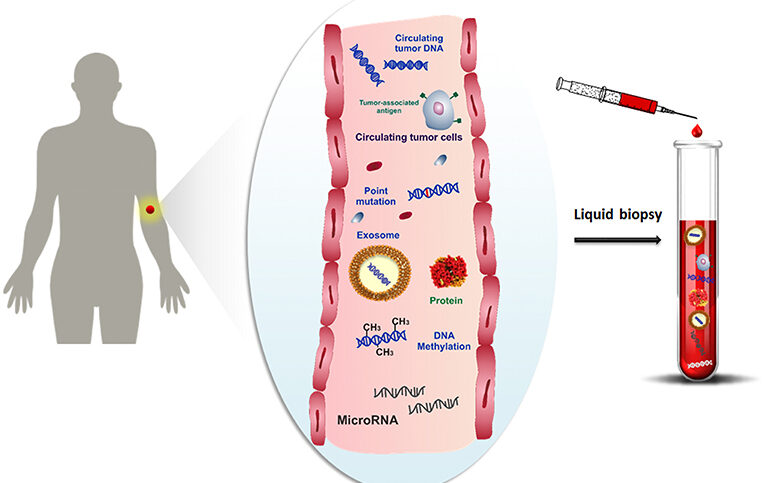
Phân tích sinh thiết lỏng có xu hướng tập trung vào ba loại dấu ấn sinh học chính, đó là tế bào khối u tuần hoàn, exosome và cell-free nucleic acids.
Tế bào khối u tuần hoàn
Tế bào khối u tuần hoàn có lẽ là một trong những dấu hiệu của bệnh ung thư lấy từ xét nghiệm sinh thiết lỏng. Một khối u rắn nguyên phát sẽ làm rụng các tế bào di chuyển vào tuỷ máu, sau đó có thể được phát hiện trong mẫu máu hoặc plasma. Cho đến nay, việc sử dụng tế bào ung thư tuần hoàn thành công nhất là ở ung thư vú, phổi và tuyến tiền liệt.
Một trong những rào cản kỹ thuật chính trong việc sử dụng tế bào ung thư tuần hoàn để phát hiện hoặc giám sát các khối u rắn là sự hiếm có tương đối của các tế bào trong tuỷ máu. Các xét nghiệm có thể phát hiện một hoặc hai tế bào ung thư tuần hoàn trong mẫu máu có dung tích tương đối nhỏ; tuy nhiên, thường cần một loại tăng cường mẫu để đảm bảo đủ độ nhạy. Các kỹ thuật tăng cường này thường yêu cầu sự kết hợp của các quy trình vật lý và sinh học như lọc dựa trên kích thước vật lý, tính điện và từ tính miễn dịch. Khi được cô lập, các tế bào có thể được mở rộng bằng các kỹ thuật nuôi cấy trong vitro trước khi phân tích. Việc thu thập các tế bào mục tiêu nguyên vẹn vẫn là một thách thức. Một khi được thu thập, các mẫu tế bào ung thư tuần hoàn có thể được phân tích bằng các kỹ thuật RT-PCR, qRT-PCR, dòng chảy tế bào, sự phát quang miễn dịch và ELISA. Các công nghệ xử lý thông tin lượng lớn được dự kiến sẽ giúp ích trong các giai đoạn khác nhau của quá trình. Các tế bào ung thư tuần hoàn có thể được sử dụng để phát hiện đột biến DNA, tạo hồ sơ biểu hiện RNA, thực hiện phân tích biểu diễn di truyền và lập hồ sơ các protein. Thật không may, dấu ấn sinh học dựa vào toàn bộ tế bào bị khối u rụng ra, điều này thường xảy ra sau khi khối u tương đối trưởng thành (tức là ở giai đoạn sau của bệnh). Vì vậy, phương pháp này không hữu ích trong việc phát hiện giai đoạn đầu và sàng lọc ung thư.
Exosomes
Exosome là các hạt gắn màng, có kích thước từ 30 đến 150nm được các tế bào khỏe mạnh và ung thư tích cực giải phóng. Các tế bào giải phóng hàng trăm nghìn exosome mỗi ngày, như vậy có thể thu thập được 1012 exosome từ một mililit máu. Hàm lượng của exosome có nồng độ cao và chứa nhiều hỗn hợp axit nucleic, peptide/protein và lipid cùng với các phân tử khác. Các tế bào sắp xếp và đóng gói có chọn lọc nội dung của exosome dựa trên trạng thái sinh lý và yêu cầu của tế bào. Tương tự như vậy, các tế bào ung thư có thể sắp xếp các oncoprotein và các phân tử khác thành các exosome có khả năng được sử dụng để phát hiện ung thư.
Là các hạt có màng, exosome tương đối ổn định trong chất lỏng cơ thể. Hơn nữa, màng ngoại bào chứa các loại chất đánh dấu protein cụ thể. Trong điều kiện bình thường, những dấu hiệu này rất quan trọng đối với việc truyền tín hiệu từ tế bào đến tế bào, nhưng có thể được khai thác trong điều kiện xét nghiệm để xác định quần thể exosome (ví dụ: exosome được giải phóng bởi tế bào tiền ung thư hoặc ung thư).
Axit nucleic tuần hoàn tự do/ DNA tự do trong máu
Thuật ngữ nucleic acids tuần hoàn tự do bao gồm một loạt các chất bao gồm DNA tự do trong máu (ctDNA), cfDNA, DNA metyl hóa, micro RNA (miRNA), messenger RNA (mRNA) và long non-coding RNA (lncRNA). Hầu hết các đoạn cfDNA đo từ 140 đến 200 cặp cơ sở, tương thích với DNA được giải phóng sau khi tế bào chết. Tuy nhiên, đã xác định được các đoạn cfDNA ngắn và dài hơn tương ứng với một số trạng thái ung thư cụ thể. ctDNA có thể được tìm thấy ở 3/4 số bệnh nhân mắc các dạng khác nhau của ung thư rắn. ctDNA được giải phóng vào tuỳ cơ của máu bởi các tế bào ung thư chết do apoptoz và tử vong. Do đó, nó có thể được sử dụng trong việc phát hiện ung thư ở giai đoạn sớm hơn so với tế bào ung thư tuần hoàn. Tỷ lệ của ctDNA so với tổng lượng cfDNA lưu hành có thể đạt tới 50% trong bệnh trạng ở giai đoạn muộn, nhưng có thể đo được khoảng 1% trong bệnh trạng ở giai đoạn sớm. Quan trọng hơn cho ứng dụng lâm sàng trong tương lai gần, ctDNA có thể phát hiện sớm tái phát ung thư. Khác với việc sử dụng tế bào ung thư tuần hoàn, không thể thực hiện nghiên cứu chức năng hoặc phân tích protein trên ctDNA; tuy nhiên, phân tích đột biến DNA và kiểm tra biểu diễn di truyền là khả thi.
Hạn chế của sinh thiết lỏng
Mặc dù các ứng dụng tiềm năng của sinh thiết lỏng trong sàng lọc, phát hiện và đáp ứng điều trị ung thư là rất nhiều nhưng vẫn có một số hạn chế đối với công nghệ này. Mặc dù rất hợp lý khi cho rằng các nhà nghiên cứu trong lĩnh vực này sẽ có thể đạt được mức độ phong phú, độ đặc hiệu và độ nhạy mẫu đầy đủ, nhưng công nghệ này cũng có một số hạn chế.
Sinh thiết lỏng hoàn toàn đòi hỏi các khối u phải sản xuất và giải phóng các chất có thể thu được từ tĩnh mạch. Các khối u nhỏ ở giai đoạn đầu có thể không sản xuất đủ chất liệu có thể sử dụng được và do đó sẽ khó khăn để phát hiện chúng. Trong khi nhiều khối u rắn phát triển nguồn cung cấp máu động mạch mạnh mẽ, một số thì không, và việc thu thập máu tĩnh mạch/tĩnh mạch có thể không đủ để phát hiện thông qua sinh thiết lỏng. Ngoài ra, màng não có thể cản trở việc sử dụng sinh thiết lỏng như một công cụ để kiểm tra và theo dõi bệnh ung thư hệ thần kinh.
Chất lượng mẫu là hạn chế quan trọng trong sinh thiết lỏng
Một trong những bài học rút ra từ xét nghiệm sinh thiết lỏng trong thực hành lâm sàng đầu tiên là chất lượng mẫu là rất quan trọng để có kết quả chính xác. Điều này có thể được minh họa tốt nhất trong xét nghiệm sinh thiết lỏng cho cfDNA. Ngay cả trong điều kiện lý tưởng, thời gian bán hủy của mảnh DNA là dưới 2h. Tổng lượng chất phân tích cũng rất nhỏ — một mililit plasma có thể chỉ chứa khoảng 10 ng của DNA tuần hoàn. Các thành phần tế bào phải được loại bỏ hoàn toàn khỏi mẫu mà không có bất kỳ sự phân ly nào, điều này sẽ gây ô nhiễm mẫu với một lượng lớn axit nucleic.
Một số tác giả đã chia sẻ kinh nghiệm của họ về xử lý xét nghiệm sinh thiết lỏng, xác định một số loại ống (PreAnalytiX PAXgene hoặc Streck BCT) có hiệu suất cao hơn so với các loại khác (EDTA). Tuy nhiên, lĩnh vực hiện tại đang thiếu một quy trình làm việc tích hợp, đã được kiểm tra tại nhiều trung tâm, đáp ứng được nhu cầu của giai đoạn tiền xử lý, phân tích và sau phân tích của mẫu. Các điều chỉnh và chuyên môn hóa có thể cần thiết cho một chỉ số sinh học cụ thể. Nói cách khác, việc thu thập và xử lý mẫu tối ưu có thể khác nhau đối với các yếu tố sinh học như tế bào ung thư tuần hoàn so với ctDNA, miRNA, exosome, vv. Công nghệ đọc kết quả dưới dạng đường dẫn hậu biến như chuỗi song song lớn cho ctDNA cũng sẽ cần phải được kiểm tra và tối ưu hóa một cách nghiêm ngặt cho các ứng dụng lâm sàng.
Việc phát triển và kiểm tra các công nghệ này cho các ứng dụng lâm sàng có thể quá lớn đối với một cá nhân hoặc công ty trong ngành công nghiệp. Đó có lẽ là lý do tại sao chỉ có hai bộ kiểm tra đã được FDA phê duyệt cho đến nay. Hệ thống CellSearch (Menarini Silicon Biosystems, Inc.) là một công cụ được FDA phê duyệt để định lượng tế bào ung thư tuần hoàn cho ba khối u di căn. Kiểm tra đột biến Cobas EGFR v2 (Roche Molecular Systems, Inc.) là một phương pháp ctDNA để phát hiện đột biến EGFR. Tuy nhiên, có hàng chục sản phẩm xét nghiệm sinh thiết lỏng, từ các loại thuốc thử và vật tư tiêu hao đến các hệ thống phân tích hoàn chỉnh và gói phần mềm đang ở các giai đoạn phát triển khác nhau.
Nguồn: https://www.mybeckman.vn/gated-media?mediaId={EA5BB845-C336-445E-B4A6-BEB2A13FDF00}
Xem thêm các giải pháp của Beckman Coulter.


 EN
EN